Klinische Studie: RESTORE ME: eine randomisierte kontrollierte Studie mit Oxalacetat zur Linderung von Müdigkeit bei Patienten mit myalgischer Enzephalomyelitis/chronischem Müdigkeitssyndrom
Aktie
Grenzen der Neurologie, t Das am dritthäufigsten zitierte Open-Access-Journal im Bereich der klinischen Neurologie mit einem Impact Factor von 3,552 hat die Ergebnisse einer randomisierten klinischen Studie (RCT) mit 82 Personen zu Oxalacetat gegen ME/CFS-Müdigkeit, die am Bateman Horne Center durchgeführt wurde, einem Peer-Review unterzogen und veröffentlicht.
-
Bei dieser Studie handelte es sich um eine randomisierte, doppelblinde klinische Studie, die am Bateman Horne Center in Salt Lake City, Utah, durchgeführt wurde. Das Bateman Horne Center ist ein gemeinnütziges Kompetenzzentrum, das sich für die Verbesserung des Lebens von Menschen mit Myalgischer Enzephalomyelitis/Chronischem Erschöpfungssyndrom (ME/CFS) und verwandten Komorbiditäten einsetzt.
-
In der klinischen Studie wurde „Oxaloacetate CFS“ (500 mg wasserfreie Enol-Oxaloacetat-Kapseln) verwendet, wobei während des dreimonatigen Versuchszeitraums täglich 2 Kapseln zum Frühstück und 2 Kapseln zum Mittagessen in einer einzigen Dosierung eingenommen wurden.
-
Die randomisierte kontrollierte Studie bestätigte, dass das medizinische Lebensmittel Oxalacetat CFS die Müdigkeit bei ME/CFS-Patienten um durchschnittlich mehr als 25 % reduzieren konnte. Die Verbesserung der Müdigkeit hielt mindestens für die Dauer der dreimonatigen Studie an.
-
Interessanterweise zeigte sich bei einer Untergruppe von 40,5 % der Patienten eine Verbesserung der Müdigkeit um > 25 %, mit einer durchschnittlichen Verbesserung von 63 % . Dies deutet darauf hin, dass Oxalacetat für diese Patientengruppe der richtige „Schlüssel“ zur Linderung der Müdigkeit ist. An der Stanford University und der University of Melbourne werden derzeit metabolomische Analysen der im Rahmen der Studie entnommenen Blutproben durchgeführt, um die wichtigsten Gründe für die positive Entwicklung dieser Untergruppe zu ermitteln.
Abstrakt
Hintergrund
Der Energiemetabolit Oxalacetat ist im Blutplasma von ME/CFS-Patienten deutlich niedriger. Eine frühere offene Studie mit Oxalacetat-Supplementierung zeigte eine signifikante Verringerung der mit myalgischer Enzephalomyelitis/chronischem Erschöpfungssyndrom (ME/CFS) verbundenen Erschöpfung.
Methoden
In dieser Folgestudie wurden 82 ME/CFS-Patienten in eine dreimonatige randomisierte, doppelblinde, kontrollierte Studie aufgenommen, die entweder 2.000 mg Oxalacetat oder eine Kontrollgruppe pro Tag erhielt. Die primären Endpunkte waren Sicherheit und Verringerung der Müdigkeit gegenüber dem Ausgangswert. Sekundäre und explorative Endpunkte umfassten die funktionelle Kapazität und den allgemeinen Gesundheitszustand.
Ergebnisse
Wasserfreies Enoloxalacetat (Oxalacetat) wurde in den getesteten Dosen gut vertragen. Oxalacetat reduzierte die Müdigkeit gegenüber dem Ausgangswert signifikant um mehr als 25 %, während die Kontrollgruppe eine nicht signifikante Reduktion von etwa 10 % zeigte. Die Intergruppenanalyse zeigte eine signifikante Abnahme des Müdigkeitsniveaus in der Oxalacetat-Gruppe ( p = 0,0039), ohne nennenswerte Veränderung in der Kontrollgruppe. Ein größerer Anteil der Probanden in der Oxalacetat-Gruppe erreichte eine Verringerung der Müdigkeit um mehr als 25 % im Vergleich zur Kontrollgruppe ( p < 0,05). Darüber hinaus wurden 40,5 % der Oxalacetat-Gruppe als „verstärkte Responder“ eingestuft, mit einer durchschnittlichen Müdigkeitsreduktion von 63 %. Sowohl die körperliche als auch die geistige Müdigkeit besserten sich durch die Oxalacetat-Supplementierung.
Abschluss
Oxalacetat ist gut verträglich und trägt wirksam zur Verringerung der Müdigkeit bei ME/CFS-Patienten bei.
Registrierung klinischer Studien
Schlüsselwörter: chronisches Erschöpfungssyndrom, ME/CFS, Oxalacetat, Erschöpfung, Erschöpfungsbehandlung, ME/CFS-Behandlung, Behandlung chronischer Erschöpfung, klinische Studie ME/CFS
Einführung
Die Centers for Disease Control and Prevention (CDC) schätzen, dass bis zu 3,3 Millionen Amerikaner an Myalgischer Enzephalomyelitis/Chronischem Erschöpfungssyndrom (ME/CFS) leiden ( 1 ). ME/CFS tritt häufig nach Virusinfektionen oder anderen akuten Stressereignissen auf und betrifft Frauen häufiger als Männer ( 2 ).
Bei ME/CFS-Patienten kommt es zu verschiedenen Stoffwechselveränderungen, darunter dem Warburg-Effekt ( 3 ) (Energiegewinnung durch Fermentation im Zytoplasma statt in den Mitochondrien), einem verringerten NAD+/NADH-Verhältnis ( 4 ), einer Aktivierung des NF-kB-Entzündungswegs ( 5 ), mitochondrialen Funktionsstörungen ( 6 ), einer verringerten Aktivierung von AMPK ( 7 ) und einer möglicherweise erhöhten Produktion reaktiver Sauerstoffspezies (ROS) ( 8 ). Frühere Untersuchungen haben gezeigt, dass die Einnahme von Oxalacetat zur Korrektur einiger dieser Störungen des Energiestoffwechsels beitragen kann ( 9 ).
Oxalacetat ist ein wichtiger Metabolit bei der Energieproduktion in den Mitochondrien im Rahmen des Krebs-Zyklus. Der Krebs-Zyklus besteht aus einer Reihe chemischer Reaktionen, die der Freisetzung gespeicherter Energie aus Kohlenhydraten/Zucker, Fetten und Proteinen im Körper dienen. Normalerweise werden bis zu 96 % der zellulären Energie über den Krebs-Zyklus gewonnen. Bei ME/CFS-Patienten ist der Energiestoffwechsel jedoch gestört, und Energie wird auch durch Fermentation im Zytoplasma außerhalb der Mitochondrien produziert ( 3 ). Diese gestörte Energieproduktion wird als „Warburg-Effekt“ bezeichnet. Dabei handelt es sich um eine Verschiebung der ATP-Energieproduktion vom Krebs-Zyklus und der oxidativen Phosphorylierung in den Mitochondrien zur Laktatproduktion durch Glykolyse im Zytoplasma der Zelle. Kürzlich wurde entdeckt, dass Oxalacetat als Signalmolekül im Zytoplasma fungiert und den Warburg-Effekt steuert ( 10 , 11 ). Oxalacetat ist auch für andere Aspekte des Stoffwechsels von entscheidender Bedeutung, darunter die Gluconeogenese, die Fettsäuresynthese, die Aminosäuresynthese, den Glyoxylatzyklus, den Harnstoffzyklus und den Milchsäurezyklus.
In Studien am Soleusmuskel von Mäusen verbesserte eine akute Oxalacetat-Supplementierung die Ermüdungsresistenz signifikant ( 12 ). Metabolomische Analysen des Plasmas von Patienten mit ME/CFS im Vergleich zu normalen Kontrollpersonen zeigten eine signifikante Reduktion des Oxalacetatspiegels ( 13 ).
Die Behandlung mit wasserfreiem Enoloxalacetat (AEO) in einer sechswöchigen offenen Proof-of-Concept-Studie mit 76 Patienten zeigte eine signifikante Verringerung der Müdigkeit bei ME/CFS-Patienten im Vergleich zu den Ausgangswerten und historischen Kontrollen ( 9 ). Diese Studie ist eine Folgestudie dieser Studie und eine dreimonatige, randomisierte, kontrollierte klinische Studie mit ME/CFS-Patienten. Unser Ziel war es, die Sicherheit und Wirksamkeit von Oxalacetat bei der Verringerung der Müdigkeit bei Patienten mit ME/CFS zu bewerten.
Materialen und Methoden
Studiendesign
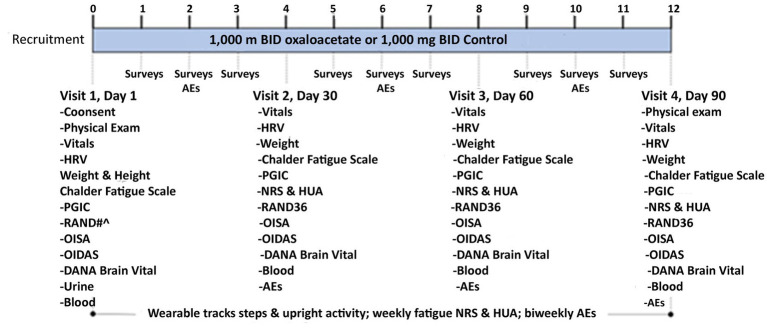
RESTORE ME war eine randomisierte, kontrollierte, doppelblinde klinische Studie mit einer oralen Dosis von 1.000 mg Oxalacetat oder 1.000 mg Reismehl, der Kontrollsubstanz, zweimal täglich ( Abbildung 1 ). Die Studie wurde am Bateman Horne Center (BHC) gemäß der Guten Klinischen Praxis und der Deklaration von Helsinki durchgeführt und vom Institutional Review Board des Institute of Regenerative and Cellular Medicine genehmigt. Diese Studie wurde registriert bei ClinicalTrials.gov ( NCT05273372 ). Alle Probanden gaben bei der Aufnahme eine schriftliche Einverständniserklärung ab ( Abbildung 2 ).
Abbildung 1.
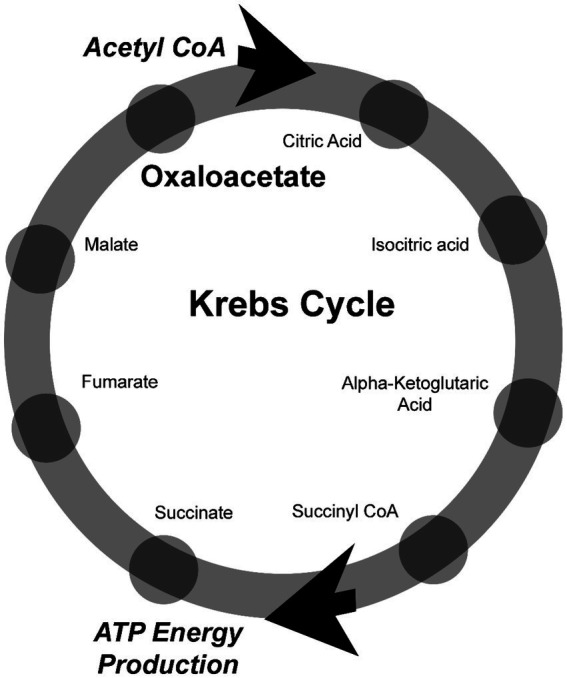
Oxalacetat ist ein wichtiger Bestandteil des Krebs-Zyklus in den Mitochondrien.
Abbildung 2.
RESTORE ME-Schema.
Es gab vier persönliche Besuche zur Beurteilung, Befragung, Urin-Schwangerschaftstest (nur Besuch 1), Verteilung und Compliance von Oxalacetat oder Kontrolle. Jede Probandin erhielt wöchentlich Online-Umfragen und alle zwei Wochen Umfragen zu unerwünschten Ereignissen (UE). Bei jedem persönlichen Besuch erhielten die Probandinnen ein voll aufgeladenes tragbares Gerät, das sie sieben Tage lang am Knöchel tragen sollten. Sie erhielten einen Umschlag, um das Gerät nach sieben Tagen an BHC zurückzusenden. Blutproben wurden entnommen und für die zukünftige Biomarker-Erkennung aufbewahrt.
Teilnehmer
An RESTORE ME nahmen Personen im Alter zwischen 18 und 65 Jahren teil, bei denen ME/CFS diagnostiziert worden war und die innerhalb der letzten drei Monate einen stabilen Krankheitszustand aufwiesen und nach eigenen Angaben 2 bis 6 Stunden pro Tag im Stehen verbrachten. Die Personen mussten beim ersten Besuch einen negativen COVID-19-Test vorweisen. Personen wurden ausgeschlossen, wenn eine andere medizinische oder psychiatrische Erkrankung vorlagen, die die ME/CFS-Symptome erklären konnte, wenn sie an schwerem ME/CFS mit weniger als 2 Stunden täglich im Stehen verbrachten oder wenn sie aktive oder unkontrollierte Komorbiditäten aufwiesen, die Müdigkeit verursachen konnten. Eine laufende Behandlung mit den folgenden Stimulanzien war ebenfalls ausgeschlossen: Methylphenidat, Amphetamin-Dextroamphetamin, Lisdexamfetamin, Modafinil und Armodafinil. Schwangere Frauen, Frauen, die innerhalb der letzten sechs Monate entbunden hatten, oder stillende Frauen waren nicht teilnahmeberechtigt. Ausschlusskriterien waren die Teilnahme an einer anderen klinischen Behandlungsstudie oder eine Besserung der Symptome aufgrund einer Behandlungsintervention in den letzten drei Monaten.
Intervention
Oxalacetat wurde in 500-mg-Kapseln verabreicht, die sich im Magen bei Kontakt mit Wasser in Enol- und Ketooxalacetat umwandeln, beides menschliche Metabolite, die an der Energieproduktion beteiligt sind. Oxalacetat gilt als medizinisches Nahrungsmittel. Als Kontrolle diente eine 500-mg-Kapsel Reismehl. Die Randomisierung erfolgte anhand von Verfahren zur Ermittlung des maximal tolerierten Ungleichgewichts unter Verwendung eines klinischen Studientools von NIH/NCI. Das Tool ist „Plug-and-Play“: https://ctrandeomiazation.cancer.gov/tool/ .
Während der Studie kam es zum Tod eines Patienten, der als schwerwiegendes unerwünschtes Ereignis eingestuft wurde. Daraufhin wurde die Studie vorübergehend unterbrochen und die Verblindung der Studie aufgehoben, um die Zugehörigkeit des verstorbenen Patienten zur Kontrollgruppe zu ermitteln. Es stellte sich heraus, dass der Patient nicht zur Oxalacetat-Gruppe, sondern zur Kontrollgruppe gehörte. Nach der Unterbrechung wurden neue Patienten mit individuellen Randomisierungsnummern erneut randomisiert. Diese Anpassung wurde vorgenommen, um sicherzustellen, dass bei weiteren schwerwiegenden Ereignissen eine Entblindung weiterer Teilnehmer nicht notwendig wäre.
Dosierung
Die Probanden erhielten einen 30-Tage-Vorrat an Oxalacetat- oder Kontrollkapseln. Während der dreimonatigen Studie sollten sie täglich zwei 500-mg-Kapseln zum Frühstück und zwei 500-mg-Kapseln zum Mittagessen einnehmen. Da Oxalacetat ein „medizinisches Nahrungsmittel“ ist, wurde als Kontrolle für diese Studie ein anderes Nahrungsmittel ausgewählt, nämlich „weißes Reismehl“. Die Dosierung wurde bei Vor-Ort-Besuchen überwacht, indem die Flaschen der Teilnehmer eingesammelt und die eingenommenen Kapseln gezählt wurden. Alle Nebenwirkungen von Oxalacetat oder der Kontrolle wurden aufgezeichnet. In dieser Studie gab es keine Gruppenschichtung, und es wurde täglich eine Einzeldosis von 2.000 mg/Tag Oxalacetat oder Kontrolle verabreicht.
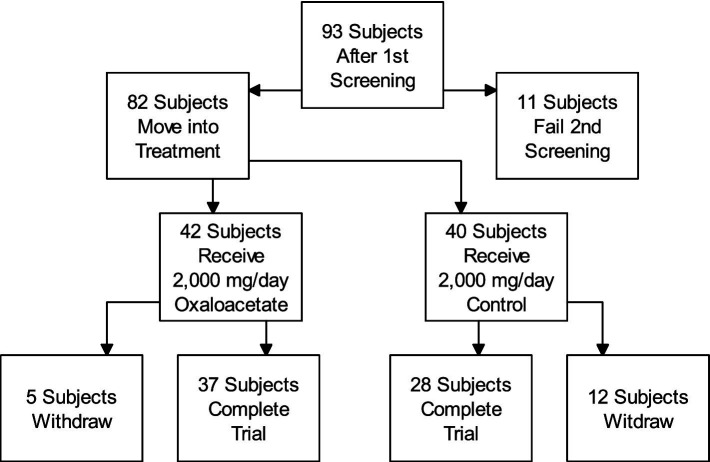
Die Zahl der Abbrüche lag in der Oxalacetat-Gruppe bei 5 von 42 und in der Placebo-Gruppe bei 12 von 40. Während der Studie hielten sich 92 % der Oxalacetat-Gruppe und 97 % der Kontrollgruppe an die Dosierung auf Grundlage der Pillenanzahl.
Ergebnisse
Die primären Endpunkte waren die Sicherheit und die Veränderung der Müdigkeit, die mit der Chalder Fatigue Scale (PROM) gemessen wurde, von Besuch 1 (Ausgangswert) bis Besuch 4 (Ende der dreimonatigen Studie). Die Chalder Fatigue Scale ist ein Fragebogen mit 11 Fragen zur Erfassung körperlicher und geistiger Müdigkeit ( 14 ).
Statistische Analyse
Die Daten wurden als Mittelwerte und Standardabweichungen zusammengefasst, Standardfehler und Konfidenzintervalle berechnet. Veränderungen wurden als Effektstärken zusammengefasst und auf eine Skala von 0–100 % normalisiert, wobei 100 % der höchste mit dem Erhebungsinstrument messbare Wert ist. Die Normalisierung der Punkte auf eine 100 %-Skala ist für die ME/CFS-Patienten, die diese Studie lesen, verständlicher. Daher wurden die Werte auf einer 100 %-Skala angegeben.
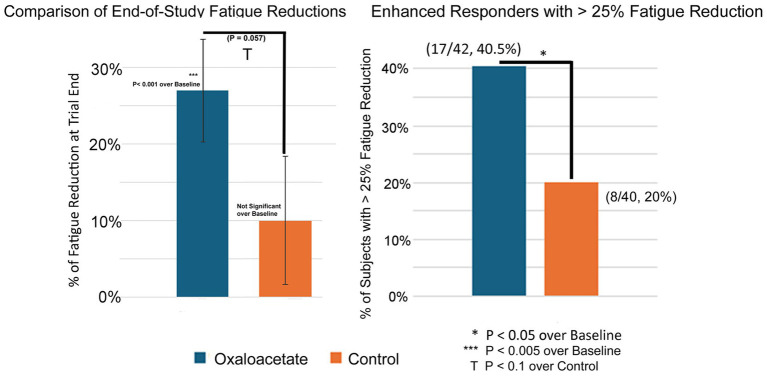
Bedeutung in Abbildung 4A wurde mithilfe der T-Test-Ergebnisse von Student in Excel berechnet, indem die Reduktionen zu Studienbeginn mithilfe gepaarter Daten und die Kontrollgruppe mithilfe von homoskedastischer Zweistichproben-Varianzen verglichen wurden. Da viele Patienten der Kontrollgruppe die Studie abbrachen, verzerrte dies den Ausgangspunkt ( p = 0,1). Um die Kontrollgruppe mit Oxalacetat zu vergleichen, wurde die individuelle Müdigkeitsreduktion jedes Patienten als Punktreduktion berechnet und anschließend die Gesamtpunktreduktion mithilfe des T-Tests ausgewertet. Der minimale klinisch wichtige Unterschied (MCID) für den binomialen Chalder-Müdigkeitsscore wurde bei Long COVID, einem ähnlichen Müdigkeitszustand, auf 1,4 bis 4 Punkte festgelegt ( 15 ). In dieser Studie wurde die klinische Signifikanz durch Reduktionen von 3 oder mehr Punkten (> 25 % Müdigkeitsreduktion) im Chalder-Müdigkeitsscore (bimodale Bewertung) gemessen, wie in gezeigt Abbildung 4B und durch insgesamt signifikante Verringerungen der Ermüdung in allen Tests.
Abbildung 4.
(A,B) 3-monatige (Studienende) Verringerung der Müdigkeit und Prozentsatz der Patienten mit einer Verringerung der Müdigkeit um >25 %.
In Abbildung 5 , McNemars Test ( 16 ) wurde verwendet, um eine 2×2-Matrix und eine kategoriale Verschiebung innerhalb jeder Behandlungsgruppe mit keiner Verschiebung der Werte zu vergleichen – im Grunde wurde nach Veränderungen der Symmetrie innerhalb jeder Gruppe gesucht. Ein niedriger Der p -Wert weist auf eine signifikante Verschiebung der Werte hin, wie sie in der Oxalacetat-Gruppe beobachtet wurde. In der Kontrollgruppe war diese Verschiebung nicht zu beobachten.
Abbildung 5.
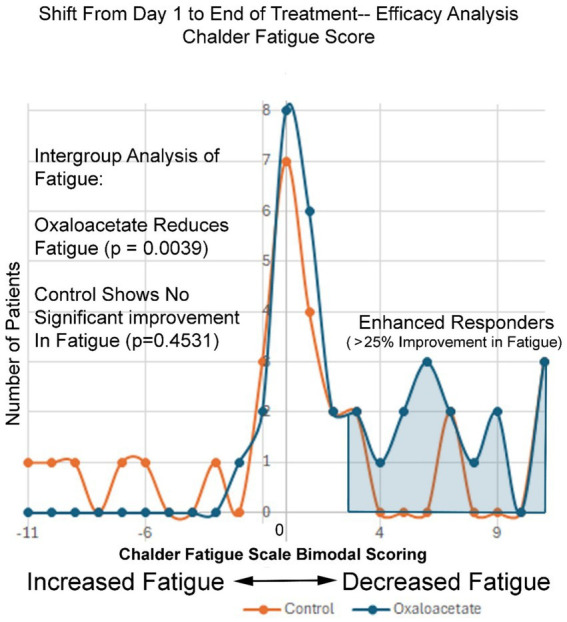
Oxalacetat reduziert das Müdigkeitsniveau, insbesondere bei „Enhanced Responders“.
In Tabelle 6 , Prognosewerte wurden als exploratives schrittweises lineares Regressionsmodell berechnet, das die Veränderung des Chalder Fatigue Scores am Tag 90 mit demografischen Informationen vergleicht. Aufgrund der inhärenten Unsicherheit prognostischer Untersuchungen, a Als Grenzwert wurde ein p -Wert von 0,15 anstelle des Standardwerts von 0,05 verwendet.
Tabelle 6.
RAND-36-Bewertung für Oxalacetat und Kontrolle.
| Rand 36 Punkte | Oxalacetat | Kontrolle | ||||
|---|---|---|---|---|---|---|
| * Zeigt an p < 0,05 über dem Ausgangswert T zeigt an p < 0,1 über dem Ausgangswert |
Basislinie | Besuch 4 | Verbesserung gegenüber dem Ausgangswert | Basislinie | Besuch 4 | Verbesserung gegenüber dem Ausgangswert |
| Rand 36 Körperliche Funktion | 20.1 | 20.3 | 1 % | 19.4 | 19.4 | 0 % |
| Rand 36 Rolleneinschränkungen aufgrund der körperlichen Gesundheit | 4.1 | 13.5 | 233 %* | 5.2 | 14.3 | 167 % |
| Rand 36 Rollenbeschränkungen aufgrund von Emotionen | 47,7 | 54.1 | 13 % | 33,3 | 40,5 | 24 % |
| Rand 36 Energie/Müdigkeit | 20.3 | 27.3 | 35 %* | 20,7 | 25.3 | 23 % |
| Rand 36 Emotionales Wohlbefinden | 63,1 | 63,9 | 1 % | 60,1 | 60,3 | 0 % |
| Rand 36 Soziales Funktionieren | 32,33 | 33.04 | −11 % | 39,19 | 34,8 | 2 % |
| Rand 36 Pain | 50,3 | 55,6 | 10 % T | 49,5 | 55 | 14 %* |
| Rand 36 Allgemeine Gesundheit | 32,8 | 35,5 | 8 % | 36,5 | 38,2 | 7 % |
| Rand 36 Gesundheitsänderung | 47,3 | 50 | 6 % | 54,3 | 55,4 | −2 % |
Ergebnisse
Der Teilnehmerfluss für diese Studie ist im beigefügten Diagramm ( Abbildung 3 ) dargestellt.
Abbildung 3.
Teilnehmerfluss.
Bei der klinischen Studie handelte es sich um eine doppelblinde, randomisierte, kontrollierte Studie zur Verwendung von 2.000 mg/Tag Oxalacetat zur Behandlung von Müdigkeit bei 82 ME/CFS-Patienten (Oxalacetat-Gruppe N = 42, Kontrollgruppe N = 40).
Grundlegende demografische Daten und Merkmale
Insgesamt waren 80 % der Probanden in der Oxalacetat-Gruppe weiblich, verglichen mit 81 % in der Kontrollgruppe. Darüber hinaus gaben 97 % der Teilnehmer der Oxalacetat-Gruppe an, weiß zu sein, während dies in der Kontrollgruppe 93 % waren. Insgesamt 57 % der Teilnehmer der Oxalacetat-Gruppe hatten seit mehr als fünf Jahren eine ME/CFS-Diagnose, verglichen mit 42,5 % in der Kontrollgruppe ( Tabelle 1 ).
Tabelle 1.
Demografie und Merkmale.
| Merkmal | Oxalacetat ( N = 42) | Kontrolle ( N = 40) |
|---|---|---|
| Alter (Jahre) | ||
| Mittelwert (SD) | 44,2 (12,63) | 45,8 (11,71) |
| Median (Q1, Q3) | 43,5 (35,0, 56,0) | 45,0 (35,5, 55,0) |
| Min., Max. | 20, 65 | 27, 64 |
| Sex | ||
| Weiblich | 34 (81,0 %) | 32 (80,0 %) |
| Männlich | 8 (19,0 %) | 8 (20,0 %) |
| Ethnizität | ||
| Hispanoamerikaner oder Latinos | 4 (9,5 %) | 1 (2,5 %) |
| Weder Hispanoamerikaner noch Latinos | 38 (90,5 %) | 36 (90,0 %) |
| Unbekannt | 0 | 1 (2,5 %) |
| Nicht gemeldet | 0 | 1 (2,5 %) |
| Fehlen | 0 | 1 (2,5 %) |
| Wettrennen | ||
| Weiß | 39 (92,9 %) | 39 (97,5 %) |
| Mehrere | 3 (7,1 %) | 0 |
| Fehlen | 0 | 1 (2,5 %) |
| Dauer von ME/CFS | ||
| 3 bis 6 Monate | 2 (4,8 %) | 2 (5,0 %) |
| 6 Monate bis 1 Jahr | 4 (9,5 %) | 4 (10,0 %) |
| 1 bis 2 Jahre | 5 (11,9 %) | 5 (12,5 %) |
| 2 bis 3 Jahre | 3 (7,1 %) | 8 (20,0 %) |
| 3 bis 4 Jahre | 3 (7,1 %) | 1 (2,5 %) |
| 4 bis 5 Jahre | 1 (2,4 %) | 2 (5,0 %) |
| 5 bis 6 Jahre | 6 (14,3 %) | 3 (7,5 %) |
| 6 bis 7 Jahre | 1 (2,4 %) | 5 (12,5 %) |
| 7 bis 8 Jahre | 2 (4,8 %) | 1 (2,5 %) |
| 8 bis 9 Jahre | 2 (4,8 %) | 1 (2,5 %) |
| 9 bis 10 Jahre | 2 (4,8 %) | 0 |
| > 10 Jahre | 11 (26,2 %) | 7 (17,5 %) |
| Fehlen | 0 | 1 (2,5 %) |
| Familienstand | ||
| Verheiratet oder in einer Partnerschaft lebend | 26 (61,9 %) | 25 (62,5 %) |
| Getrennt | 0 | 1 (1,2 %) |
| Geschieden | 5 (11,9 %) | 7 (17,5 %) |
| Verwitwet | 0 | 1 (2,5 %) |
| Nie verheiratet | 11 (26,2 %) | 5 (12,5) |
| Fehlen | 0 | 1 (2,5 %) |
| Bildungsniveau | ||
| Abiturient | 5 (11,9 %) | 1 (2,5 %) |
| GED oder gleichwertig | 1 (2,4 %) | 0 |
| Einige College-Abschlüsse, kein Abschluss | 6 (14,3 %) | 8 (20,0 %) |
| Associate Degree: berufsbegleitend | 4 (9,5 %) | 4 (10,0 %) |
| Associate Degree: akademisch | 2 (4,8 %) | 4 (10,0 %) |
| Bachelor-Abschluss | 11 (26,2 %) | 13 (32,5 %) |
| Master-Abschluss | 8 (19,0 %) | 6 (15,0 %) |
| Berufsschulabschluss | 2 (4,8 %) | 1 (2,5 %) |
| Doktorgrad | 0 | 1 (2,5 %) |
| Abgelehnt | 3 (7,1 %) | 1 (2,5 %) |
| Fehlen | 0 | 1 (2,5 %) |
| Anzahl der Kinder | ||
| 0 | 15 (35,7 %) | 11 (27,5 %) |
| 1 | 4 (9,5 %) | 3 (7,5 %) |
| 2 | 9 (21,4 %) | 10 (25,0 %) |
| 3 | 8 (19,0 %) | 8 (20,0 %) |
| 4 oder mehr | 4 (9,5 %) | 6 (15,0 %) |
| Fehlen | 2 (4,8 T) | 2 (5,0 %) |
| Arbeitsstatus | ||
| Arbeite jetzt | 15 (35,7 %) | 14 (35,0 %) |
| Nur vorübergehend entlassen | 1 (2,4 %) | 1 (2,5 %) |
| Arbeitssuchend, arbeitslos | 2 (4,8 %) | 2 (5,0 %) |
| Im Ruhestand | 2 (4,8 %) | 1 (2,5 %) |
| Deaktiviert | 13 (31,0 %) | 15 (37,5 %) |
| Haushalt führen | 5 (11,9 %) | 4 (10,0 %) |
| Student | 1 (2,4 %) | 0 |
| Andere | 3 (7,1 %) | 2 (2,5 %) |
| Fehlen | 0 | 1 (2,5 %) |
Sicherheit
Unsere primären Endpunkte der Studie waren Sicherheit und die Verringerung von Müdigkeit. Es gab keine bemerkenswerten Veränderungen der Vitalfunktionen zwischen den beiden Gruppen. In der Oxalacetat-Gruppe traten keine schwerwiegenden behandlungsbedingten unerwünschten Ereignisse (TEAE) auf. Als TEAE gelten alle Ereignisse, die am oder nach dem Registrierungsdatum gemeldet werden. In der Kontrollgruppe gab es drei schwerwiegende TEAE (darunter ein Todesfall). Die häufigsten möglicherweise damit verbundenen nicht schwerwiegenden TEAE in der Oxalacetat-Gruppe (über 5 %) waren Kopfschmerzen und Übelkeit (jeweils 3). In der Kontrollgruppe gab es viele ähnliche nicht schwerwiegende TEAE, aber sechs schwere Fälle. In der Oxalacetat-Gruppe gab es zwei Fälle nicht schwerwiegender TEAE, die schwerwiegend waren, wobei ein Patient unter Übelkeit und Bauchschmerzen litt. Insgesamt wurde Oxalacetat von dieser Teilnehmergruppe gut vertragen ( Tabelle 3 ).
Tabelle 3.
Gesamtzahl der TEAE nach Schweregrad.
| Oxalacetat ( N = 42) | Kontrolle ( N = 40) | |
|---|---|---|
| Gesamtzahl der TEAEs | 41 | 40 |
| Anzahl (%) der Teilnehmer, die mindestens eine | ||
| TEAE | 22 (52,4 %) | 16 (40,0 %) |
| Ernsthaftes TEAE | 0 | 3 (7,5 %) |
| Verwandte TEAE | 12 (28,6 %) | 7 (17,5 %) |
| Maximaler Schweregrad | ||
| Leicht | 10 (23,8 %) | 5 (12,5 %) |
| Mäßig | 11 (26,2 %) | 5 (12,5 %) |
| Schwer | 2 (4,8 %) | 6 (15,0 %) |
Der einzige Teilnehmer der Oxalacetat-Gruppe, der unter starker Übelkeit und Bauchschmerzen litt, brach die Therapie aufgrund dieses TEAE ab. Im Gegensatz dazu brachen alle anderen Oxalacetat-Teilnehmer die Therapie aus anderen Gründen als TEAE ab.
Ermüdung
Der Chalder Fatigue Score wurde in dieser Studie als primäres Maß für die Wirksamkeit der Müdigkeitsreduktion festgelegt. In der Oxalacetat-Gruppe wurde eine signifikante durchschnittliche Müdigkeitsreduktion von 27 % gegenüber dem Ausgangswert verzeichnet, während die Reduktion in der Kontrollgruppe nicht signifikant war ( Abbildung 4A ). Am Ende der Studie zeigte die Oxalacetat-Gruppe eine signifikante Verbesserung gegenüber der Kontrollgruppe ( p = 0,057).
Die Oxalacetat-Gruppe enthielt eine Untergruppe von „ verstärkten Respondern “, definiert als Patienten mit einer Müdigkeitsreduktion von mehr als 25 %. Die Anzahl der verstärkten Responder war signifikant höher als in der Kontrollgruppe (40,5 % Oxalacetat-Gruppe vs. 20 % Kontrollgruppe). Abbildung 4B ) und zeigte eine 63%ige Verringerung der Müdigkeit .
Eine Intergruppenanalyse sowohl der Gesamtheit aller Teilnehmer (einschließlich der Studienabbrecher) als auch der Teilnehmer, die die gesamte dreimonatige Studie durchgemacht hatten, zeigte eine signifikante Verschiebung hin zu niedrigeren Müdigkeitsniveaus in der Oxalacetat-Gruppe, jedoch nicht in der Kontrollgruppe ( p = 0,0039 Oxalacetat), ( p = 0,4531 Kontrollgruppe „abgeschlossene Probanden“) ( p = 0,1094 Kontrollgruppe „alle Probanden“).
Abbildung 5 zeigt die Häufigkeit der Veränderungen des Chalder-Fatigue-Scores vom Ausgangswert bis zum Ende des dreimonatigen Studienzeitraums. Die Normalverteilung der Ermüdungsveränderungen in der Kontrollgruppe zeigt eine glockenförmige Normalverteilung der Ermüdungswerte, wobei die meisten Werte wenig bis keine Veränderungen zeigen und Ausreißer sowohl negative als auch positive Veränderungen der Ermüdung am Ende der Studie zeigen. Die negative 11- bis positive 11-Punkte-Skala erfasst die Veränderung des Chalder-Fatigue-Scores vom Ausgangswert bis zum Ende der Studie, wobei jeder Teilstrich einem Punkt auf der bimodalen Chalder-Skala entspricht. Im Gegensatz dazu zeigt die Oxalacetat-Gruppe nahezu keine negativen Werte, da die Ermüdungsgrade der gesamten Gruppe nach rechts verschoben waren (verminderte Ermüdung). Rechts von In Abbildung 5 ist die Gruppe der Personen mit verstärkter Responderwirkung zu sehen ( Tabelle 4 ).
Tabelle 4.
Reduzierung des Chalder-Ermüdungswerts.
| * Zeigt an p < 0,05 über dem Ausgangswert | Oxalacetat | Verbesserung gegenüber dem Ausgangswert | Kontrolle | Verbesserung gegenüber dem Ausgangswert | ||
|---|---|---|---|---|---|---|
| Basislinie | Ende | Basislinie | Ende | |||
| Chalder-Ermüdungsindex, alle Teilnehmer | 9.1 | 6.6 | 27% *** | 8,5 | 7.1 | 17% * |
| Chalder-Ermüdungsscore, Teilnehmer der Studie abgeschlossen | 9.1 | 6.2 | 32 %*** T (Überkontrolle) | 8.1 | 7,0 | 14 % |
| CFS, N der verbesserten Responder >25 % Verbesserung | 17/42 | 40,5 % * (über Kontrolle) | 8/40 | 20 % | ||
| OAA-verstärkte Responder % Müdigkeitsverbesserung | 63 % *** | |||||
| CFS, McNemars Schichtanalyse, vollständiger Satz P Wert | P = 0,0039 *** | P = 0,1094 | ||||
| McNemars Schichtanalyse, abgeschlossene Teilnehmer P | P = 0,0039 *** | P = 0,4531 | ||||
Es wurde ein exploratives schrittweises lineares Regressionsmodell erstellt, um die Auswirkungen potenzieller demografischer Prognosefaktoren zu analysieren, die zu einer positiven Veränderung des Chalder Fatigue Scores (CFS, bimodal) um mehr als 25 % führen könnten. Zu den Faktoren, die die Chancen auf einen Wechsel in die Gruppe der „Enhanced Responder“ (mit einer Signifikanz von 0,1500 im Modell) verbesserten, gehörten der anfängliche Basiswert der Chalder Fatigue Scale, die Dauer von ME/CFS, der RAND-36-Basiswert für Energie/Fatigue und die Frage, ob der Teilnehmer eine Arbeitsstelle suchte. Diese Variablen könnten potenzielle Prädiktoren für eine Verbesserung des Chalder Fatigue Scores um mehr als 25 % bis zum Ende dieser dreimonatigen Studie sein.
Andere demografische Unterschiede, darunter Alter, Geschlecht, ethnische Zugehörigkeit, Rasse, Familienstand, Bildungsniveau und Anzahl der Kinder, erreichten keine prädiktive Signifikanz von mindestens 0,1500. Die Ergebnisse der Chalder Fatigue Scale werden dadurch unterstützt, dass der RAND-36-Energie-/Müdigkeitswert für die Oxalacetat-Gruppe signifikant über dem Ausgangswert lag ( p = 0,012), nicht jedoch für die Kontrollgruppe ( p = 0,16). Auch die Müdigkeitsreduktion war für die Oxalacetat-Gruppe signifikant höher als für die Kontrollgruppe ( p = 0,044).
Diskussion
Oxalacetat wurde in einer Dosierung von 2.000 mg/Tag gut vertragen. Die häufigsten behandlungsbedingten Nebenwirkungen in dieser dreimonatigen Studie waren Kopfschmerzen (3/42) und Übelkeit (3/42). Einzelberichte von anderen Probanden, die höhere Dosen Oxalacetat einnahmen, berichten, dass Übelkeit, falls sie auftritt, abnimmt, wenn das Oxalacetat zusammen mit einer vollen Mahlzeit eingenommen wird.
Bei den Chalder Fatigue Scores gab es eine allgemeine Verringerung der Erschöpfung um 27 bis 32 %, was in der Oxalacetat-Gruppe in einer 3-monatigen Studie eine signifikante, anhaltende Veränderung gegenüber dem Ausgangswert darstellt. Die Kontrollgruppe verzeichnete eine Verringerung der Erschöpfung um 17 %, was nur dann signifikant war, wenn Teilnehmer, die die Studie abgebrochen hatten, in die Berechnungen einbezogen wurden. Die Kontrollgruppe erreichte bei den Probanden, die die Studie abgeschlossen hatten, keine Signifikanz. Die Intergruppenanalyse sowohl aller Teilnehmer (einschließlich der Studienabbrecher) als auch der Teilnehmer, die die gesamte 3-monatige Studie durchlaufen hatten, zeigte eine signifikante Verschiebung hin zu niedrigeren Erschöpfungsniveaus in der Oxalacetat-Gruppe, jedoch nicht in der Kontrollgruppe ( p = 0,0039 Oxalacetat), ( p = 0,4531 Kontrollgruppe „Probanden, die die Studie abgeschlossen hatten“) ( p = 0,1094 Kontrollgruppe „alle Probanden“). Diese gruppenweite Verschiebung der Erschöpfung hin zu einem besseren Energieniveau kann in der gesamten Oxalacetat-Gruppe beobachtet werden. Betrachtet man jeden Verbesserungspunkt auf der Chalder Fatigue Scale und die Häufigkeit ausgehend vom Mittelwert, so umfasste diese Verschiebung Patienten mit geringer Reaktion, die sich insgesamt um 42 Punkte über den Erwartungen verbesserten (im Vergleich zur Kontrollgruppe), sowie Patienten mit verstärkter Reaktion, die sich um 60 Punkte über den Erwartungen verbesserten. Die Verschiebung hin zu einem höheren Energieniveau erhöhte auch die Anzahl der Patienten mit verstärkter Reaktion signifikant, definiert als Patienten mit einer Müdigkeitsreduktion von mehr als 25 % (40,5 % Oxalacetat-Gruppe vs. 20 % Kontrollgruppe). Darüber hinaus zeigten 40,5 % der Teilnehmer der Oxalacetat-Gruppe, die zu den „verstärkten Reaktionen“ zählten, eine 63-prozentige Verbesserung der Müdigkeit.
Die Chalder Fatigue Scale wird häufig in ME/CFS-Studien verwendet und ist für leichte und mittelschwere ME/CFS-Fatigue validiert. In sehr schweren Fällen tritt ein „Deckeneffekt“-Problem auf, bei dem die Erschöpfung zu hoch ist, um mit der Chalder Fatigue Scale gemessen zu werden ( 17 ).
Der RAND-36 wird auch in ME/CFS-Studien verwendet und ist für leichtes und mittelschweres ME/CFS validiert. Die Oxalacetat-Gruppe zeigte eine signifikante Reduktion der Müdigkeit um 35 % gegenüber dem Ausgangswert, während die Kontrollgruppe bei dieser Messung keine signifikante Reduktion verzeichnete. Die Kontrollgruppe zeigte keine signifikante Reduktion von Energie/Müdigkeit. Diese zweite Umfrage unterstützt die Ergebnisse der Chalder Fatigue Scale.
Sowohl die Chalder Fatigue Scale als auch der RAND-36 sind patientenberichtete Ergebnismessungen (PROM) und unterliegen zahlreichen Verzerrungsquellen, darunter Abweichungen in der Interpretation der Fragen und Antwortmöglichkeiten ( 18 ). Eine weitere Verzerrungsquelle könnte darin liegen, dass die Probanden dieser monozentrischen Studie ihre Ergebnisse zwar teilten, jedoch versucht wurde, den Kontakt zu minimieren. Da die Probanden mit verbesserter Reaktion eine durchschnittliche Verbesserung der Müdigkeit um 63 % im Chalder Fatigue Score feststellten, könnte dies andere in der Oxalacetat- und Kontrollgruppe beeinflusst haben, wodurch PROMs weniger praktikabel werden.
Tabelle 5 bespricht die potenziellen prognostischen demografischen Faktoren, die die Wahrscheinlichkeit erhöhen können, dass sich die Erschöpfung (gemessen mit der Chalder-Fatigue-Skala) bei Patienten nach 90 Tagen um mehr als 25 % verbessert. Zu diesen demografischen Faktoren gehören ein positiver Zusammenhang mit erhöhten Chalder-Fatigue-Scores zu Studienbeginn und ein negativer Zusammenhang mit erhöhten RAND-36-Energie-/Erschöpfungsscores zu Studienbeginn, der Dauer der ME/CFS-Erkrankung und dem Arbeitslosenstatus. Die Signifikanz des bimodalen CFS-Basiswerts als Prognosefaktor ist möglicherweise nicht wichtig. Höhere Basiswerte führen eher zu einer Besserung, unabhängig von der erhaltenen Behandlung, da mehr Raum für Verbesserungen besteht. Dagegen spricht jedoch die Tatsache, dass die RAND-36-Energie-/Erschöpfungsskala den gegenteiligen Effekt zeigt, d. h., niedrigere Basiswerte sind mit einer besseren Behandlung der Erschöpfung verbunden.
Tabelle 5.
Exploratives prognostisches schrittweises lineares Regressionsmodell zur Einordnung in die Gruppe der verbesserten Responder.
| Schritt | Eingegebene Variable | Partielles R-Quadrat | Modell R-Quadrat | C (p) | F Wert | Pr > F |
|---|---|---|---|---|---|---|
| 1 | Bimodaler CFS-Basiswert | 0,1749 | 0,1749 | 2,1134 | 12.3 | 0,0009 |
| 2 | Dauer von ME/CFS | 0,0995 | 0,2744 | −2,8935 | 7,82 | 0,007 |
| 3 | RAND-36-Ermüdungsbasislinie | 0,0357 | 0,3101 | −3,4053 | 2,89 | 0,0944 |
| 4 | Arbeitssuchend, arbeitslos | 0,032 | 0,342 | −3,6579 | 2,67 | 0,1077 |
Es wurde eine starke signifikante Korrelation (0,007) zwischen der Dauer von ME/CFS und der Wahrscheinlichkeit einer verbesserten Reaktion auf die Oxalacetat-Behandlung beobachtet – je länger die Dauer von ME/CFS, desto wahrscheinlicher war eine stärkere Reaktion des Teilnehmers. Dies könnte jedoch darauf zurückzuführen sein, dass Patienten mit längerer Krankheitsdauer mit einem höheren Müdigkeitsgrad begannen. Der negative Zusammenhang mit Arbeitslosigkeit ist wahrscheinlich auf die geringe Stichprobengröße zurückzuführen – nur zwei Teilnehmer der Oxalacetat-Gruppe wurden als „arbeitslos, arbeitssuchend“ eingestuft. Daher trotz der geringen Trotz der p -Werte im Modell bleiben die prognostischen Faktoren auf Grundlage der Patientendemografie in dieser Studie unklar. Wir gehen davon aus, dass die laufende metabolomische Analyse der Patienten weitere Erkenntnisse über prognostische Faktoren für eine Verbesserung liefern wird.
Es gibt mehrere Mechanismen, durch die Oxalacetat zur Behandlung von Patienten mit ME/CFS eingesetzt werden kann. Die identifizierten Mechanismen sind unten aufgeführt in Tabelle 7 Dazu gehören Verbesserungen der zellulären Energiefunktionen, der Wiederherstellung des Immunsystems, der Funktion des Glukosesystems und des neurologischen antioxidativen Schutzes. Wir sind uns derzeit nicht sicher, welcher dieser vielfältigen Mechanismen am wirksamsten zur Verringerung von Müdigkeit beiträgt. Im Rahmen der Studie entnommene Blutproben könnten wertvolle Erkenntnisse liefern, und die Stoffwechselanalyse der Proben wird derzeit in mehreren Einrichtungen durchgeführt. Die in der Oxalacetat-Gruppe beobachtete Verbesserung des Müdigkeitsniveaus entspricht der Verbesserung, die in der vorherigen klinischen Proof-of-Concept-Studie festgestellt wurde.
Tabelle 7.
Stoffwechselveränderungen durch Oxalacetat, die die Müdigkeit bei ME/CFS-Patienten lindern können.
| Stoffwechselveränderung | Auswirkungen auf ME/CFS-Patienten | Normalisierung durch Oxalacetat |
|---|---|---|
| Warburg-Effekt | Erhöhte Laktatproduktion | Reduktion der Laktatproduktion durch Hemmung der Laktatdehydrogenase im Zytosol |
| Abnahme des NAD+/NADH-Verhältnisses | Steigerung der ROS-Produktion | Zurücksetzen des NAD+/NADH-Verhältnisses und Löschen von ROS durch das Antioxidans Oxalacetat |
| Erhöhte NF-kB-Bewegung zum Zellkern | Aktivierung chronischer Entzündungen | Normalisierung des Entzündungsverlaufs durch Verringerung der NF-kB-Translokation in den Zellkern |
| Mitochondriale Schäden | Reduzierte Fähigkeit, Glukose zu verarbeiten | Erhöhte Anzahl von Mitochondrien zur Energieproduktion durch PGC1-alpha-Anstieg |
| Reduzierte AMPK-Aktivierung | Reduzierte zelluläre Glukoseaufnahme | Erhöhte Glukoseaufnahme durch AMPK-Aktivierung und mehr Glukose als Brennstoff für den Patienten |
| Erhöhte neurologische ROS-Produktion | Schäden durch freie Radikale | Oxalacetat ist ein hochwirksames Antioxidans. |
In unserer vorherigen Studie vermuteten wir, dass die Verbesserungen der Müdigkeit auf die Normalisierung gestörter Stoffwechselwege zurückzuführen sein könnten. Wir diskutierten kurz die bekannten Stoffwechselveränderungen, die durch Oxalacetat hervorgerufen werden und die Müdigkeit potenziell reduzieren könnten.
Abnorme Energieproduktion durch erhöhte Glykolyse und erhöhte Laktatproduktion in ME/CFS-Zellen (der „Warburg-Effekt“)
Zellen von Menschen mit ME/CFS weisen eine abnormale Energieproduktion auf, wobei mehr Energie im Zytoplasma durch erhöhte Glykolyse und Fermentation produziert wird, anstatt in den Mitochondrien ( 3 ). Dies ist auch als „Warburg-Effekt“ bekannt und tritt häufig im Stoffwechsel von Krebszellen auf. Einst galt dies als dauerhafte Stoffwechselveränderung, doch in den letzten Jahren konnte gezeigt werden, dass die Zufuhr von Oxalacetat in das Zytoplasma der Zellen den Warburg-Effekt umkehren kann ( 10 , 11 ). Dadurch wird die Laktatproduktion in der Zelle reduziert, ein häufiges Problem bei ME/CFS-Patienten. Es wird angenommen, dass der abnormale Anstieg des Laktatspiegels bei körperlicher Betätigung bei ME/CFS-Patienten eine postexertionale Malaise (PEM) verursacht ( 19 ).
Zellen von Patienten mit Müdigkeit weisen deutlich niedrigere Redoxwerte (NAD + /NADH-Verhältnis) auf
Bei müden Patienten kommt es zu einem Abfall der NAD+/NADH-Werte im Zytoplasma ( 4 ). Dieses Redox-Ungleichgewicht kann mit Oxalacetat ( 20 , 21 ). Der Anstieg des NAD+-Spiegels und der Abfall des NADH-Spiegels werden durch die Umwandlung von Oxalacetat in Malat durch das zytosolische Enzym Malatdehydrogenase verursacht. Die biochemische Reaktion hat eine Gibbs-Energie von −29,7 kJ/mol, was darauf hindeutet, dass diese Reaktion mit hoher Wahrscheinlichkeit spontan auftritt. Krebs maß die Veränderung des NAD+/NADH-Verhältnisses durch zusätzliches Oxalacetat als 900%igen Anstieg innerhalb von 2 Minuten ( 22 ).
Anhaltende NF-kB-Entzündungsreduktion
Zellen von Personen mit ME/CFS zeigen eine erhöhte Aktivierung von NF-kB, was zu dauerhaft erhöhten Konzentrationen von Entzündungsproteinen führt ( 5 ). Oxalacetat reduzierte die Aktivierung von NF-kB in Tiermodellen um bis zu 70 % ( 20 ), indem es die Translokation von NF-kB vom Zytosol in den Zellkern reduzierte. Die Verringerung der chronischen Entzündung kann die anhaltende Müdigkeit bei ME/CFS-Patienten verringern.
Mitochondriale Schäden treten bei ME/CFS-Patienten häufig auf
Mitochondriale Schäden sind ein vermuteter Mechanismus von ME/CFS ( 6 , 23 ). Oxalacetat erhöht nachweislich die mitochondriale Dichte durch die Hochregulierung von PGC-1 alpha ( 20 ). Eine Erhöhung der mitochondrialen Dichte ermöglicht den Ersatz geschädigter Mitochondrien.
Reduktion der Aktivierung der AMP-aktivierten Proteinkinase (AMPK)
Bei ME/CFS-Patienten wurde ein Versagen der AMPK-Aktivierung nachgewiesen ( 7 ). Die AMPK-Aktivierung ist entscheidend für die Erhöhung der Glukoseaufnahme in die Zellen in Zeiten geringer Energie ( 7 , 24 ). Oxalacetat erhöht die AMPK-Aktivierung durch eine Erhöhung des NAD+/NADH-Verhältnisses. Es wurde in Diabetes- und Alzheimer-Studien zur Verbesserung der Glukoseaufnahme eingesetzt ( 25 , 26 ). Ausreichend Glukose zur Energieproduktion reduziert die Müdigkeit.
Reduktion reaktiver Sauerstoffspezies (ROS)
Eine Überproduktion von ROS aufgrund des Warburg-Effekts, der in ME/CFS-Zellen beobachtet wird, kann Zellkomponenten schädigen. Oxalacetat ist ein starkes Antioxidans, das sowohl Thiobarbitursäure als auch Wasserstoffperoxid im Gehirn reduziert ( 27 , 28 ). Oxalacetat schützt außerdem die mitochondriale DNA vor Schäden durch Substanzen wie Kainsäure ( 29 ). Die Reduzierung der ROS-Produktion trägt dazu bei, die Funktionsfähigkeit der Zellen aufrechtzuerhalten.
Diese sechs Stoffwechselveränderungen bei ME/CFS- und anderen Erschöpfungspatienten könnten die treibende Kraft der Erschöpfung sein. Die Normalisierung dieser Stoffwechselveränderungen durch Oxalacetat kann einen Zustand ohne Erschöpfung wiederherstellen.
Eine Übersichtstabelle zu Stoffwechselproblemen bei ME/CFS und den möglichen Auswirkungen von Oxalacetat auf diese Stoffwechselwege wird erneut veröffentlicht in Tabelle 2 ( 9 ).
Tabelle 2.
Nicht schwerwiegende behandlungsbedingte unerwünschte Ereignisse (TEAE).
| Im Zusammenhang mit der Behandlung aufgetretene unerwünschte Ereignisse Gemeldeter Begriff | Oxalacetat ( N = 42) | Kontrolle ( N = 40) |
|---|---|---|
| Kopfschmerzen | 3 (7,1 %) | 0 |
| Brechreiz | 3 (7,1 %) | 1 (2,5 %) |
| Durchfall | 1 (2,4 %) | 1 (2,5 %) |
| Bauchkrämpfe | 2 (4,8 %) | 0 |
| Bauchschmerzen | 2 (4,8 %) | 0 |
| Veränderung der Stuhlgewohnheiten | 1 (2,4 %) | 1 (2,5 %) |
| Brustschmerzen | 0 | 1 (2,5 %) |
| Migräne | 0 | 1 (2,5 %) |
| Harnwegsinfektion | 0 | 1 (2,5 %) |
| Anorexie | 1 (2,4 %) | 0 |
| Zervikogener Kopfschmerz | 1 (2,4 %) | 0 |
| Trockene Nase | 1 (2,4 %) | 0 |
| Presslufthammer-Ösophagus | 0 | 1 (2,5 %) |
| Hitzewallungen | 1 (2,4 %) | 0 |
| Intermittierender Druck auf der Brust | 1 (2,4 %) | 0 |
| Unterleibsschmerzen | 1 (2,4 %) | 0 |
| Myalgien der Rautenmuskeln entlang der Wirbelsäule | 1 (2,4 %) | 0 |
| Taubheitsgefühl im linken Bein | 0 | 1 (2,5 %) |
| Taubheitsgefühl im Gesicht | 0 | 1 (2,5 %) |
| Taubheitsgefühl im linken Arm | 0 | 1 (2,5 %) |
| Schmerzen in der linken Kieferseite | 0 | 1 (2,5 %) |
| Juckreiz im linken Arm | 0 | 1 (2,5 %) |
| Nasennebenhöhlenentzündung | 0 | 1 (2,5 %) |
| Muskelkater | 1 (2,4 %) | 0 |
| Magenverstimmung | 1 (2,4 %) | 0 |
| Gedanken an Selbstverletzung | 0 | 1 (2,5 %) |
| Sich erbrechen | 0 | 1 (2,5 %) |
| Wortfindungsschwierigkeiten | 1 (2,4 %) | 0 |
| Verschlechterung des Bluthochdrucks | 0 | 1 (2,5 %) |
Die Teilnehmer dieser Studie litten an leichtem bis mittelschwerem ME/CFS und wurden speziell ausgewählt, da Veränderungen ihres Erschöpfungsniveaus mithilfe bestehender validierter Erhebungen gemessen werden konnten, ohne dass der durch übermäßig hohe Erschöpfungsniveaus verursachte „Deckeneffekt“ auftrat. Zukünftige Studien könnten die Wirkung von Oxalacetat auf Patienten mit schwerem ME/CFS untersuchen, sofern validierte Erhebungen entwickelt werden, die für diese Bevölkerungsgruppe geeignet sind.
Abschluss
Diese dreimonatige, doppelblinde, randomisierte, kontrollierte klinische Studie zeigte, dass Oxalacetat von ME/CFS-Patienten in einer Dosierung von 2.000 mg/Tag (1.000 mg zweimal täglich zu einer Mahlzeit) gut vertragen wurde. Die Studie zeigte eine signifikante und anhaltende Verringerung der Müdigkeit gegenüber dem Ausgangswert um 27 bis 32 %, die in der Kontrollgruppe nicht beobachtet wurde. Die Intergruppenanalyse zeigte eine signifikante Verringerung des Müdigkeitsniveaus in der Oxalacetat-Gruppe, die in der Kontrollgruppe nicht auftrat. Darüber hinaus zeigten etwa 40 % der Oxalacetat-Gruppe, die sogenannten „verstärkten Responder“, eine durchschnittliche Müdigkeitsreduktion von 63 % gegenüber dem Ausgangswert, und diese Untergruppe war im Vergleich zur Kontrollgruppe signifikant größer.
Oxalacetat hat sich als wirksames und gut verträgliches medizinisches Nahrungsmittel zur Verringerung von Müdigkeit bei Personen mit leichtem bis mittelschwerem ME/CFS erwiesen. Weitere Forschung ist erforderlich, um den potenziellen Nutzen bei der Linderung von Müdigkeit bei Patienten mit schwerem ME/CFS zu bewerten.
Danksagung
Die Autoren danken dem Bateman Horne Center für seine Expertise im Bereich ME/CFS und für die Durchführung der verblindeten klinischen Studie.
Finanzierungserklärung
Die Autoren erklären, dass sie für die Forschung, die Autorenschaft und/oder die Veröffentlichung dieses Artikels finanzielle Unterstützung erhalten haben. Diese Studie wurde von Terra Biological LLC finanziert, die verblindete Wirkstoffe und Kontrollpräparate für die Studie bereitstellte. Ein Mitarbeiter von Terra Biological war zusammen mit allen anderen Autoren an der Gruppenstudienplanung und der Überprüfung des Artikels beteiligt. Der Geldgeber war nicht an der Rekrutierung der Studienteilnehmer, der Datenerhebung, der Daten-/Probenspeicherung, der anfänglichen Datenanalyse oder der Entscheidung über die Einreichung zur Veröffentlichung beteiligt.
Abkürzungen
AEO, wasserfreies Enoloxalacetat; AMPK, AMP-aktivierte Proteinkinase; BID, zweimal tägliche Dosierung; ME/CFS, Myalgische Enzephalomyelitis/Chronisches Erschöpfungssyndrom; NF-kB, Nuklearer Faktor Kappa B, NAD+; NADH, Nicotinamidadenindinukleotid; ROS, Reaktive Sauerstoffspezies.
Datenverfügbarkeitserklärung
Die in dieser Studie vorgestellten Datensätze sind in Online-Repositorien verfügbar. Die Namen der Repositorien und die Zugangsnummern finden Sie unter: https://doi.org/10.7910/DVN/KBCE6H .
Ethikerklärung
Die Studien am Menschen wurden vom Institutional Review Board des Institute of Regenerative and Cellular Medicine genehmigt. Die Studien wurden gemäß den lokalen Gesetzen und institutionellen Anforderungen durchgeführt. Die Teilnehmer gaben ihre schriftliche Einverständniserklärung zur Teilnahme an dieser Studie ab.
Autorenbeiträge
AC: Konzeptualisierung, formale Analyse, Mittelbeschaffung, Methodik, Ressourcen, Visualisierung, Schreiben – Originalentwurf, Schreiben – Überprüfung und Bearbeitung. SV: Schreiben – Originalentwurf, Schreiben – Überprüfung und Bearbeitung. CR: Schreiben – Überprüfung und Bearbeitung. LB: Schreiben – Überprüfung und Bearbeitung. SA: Schreiben – Überprüfung und Bearbeitung. JB: Schreiben – Überprüfung und Bearbeitung. BY: Schreiben – Überprüfung und Bearbeitung. DK: Schreiben – Überprüfung und Bearbeitung.
Interessenkonflikt
Der Hauptautor AC ist leitender Angestellter der Finanzierungsgesellschaft Terra Biological LLC, die Oxalacetat zur Behandlung von Müdigkeit vermarktet.
Die übrigen Autoren erklären, dass die Forschung ohne jegliche kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Anmerkung des Herausgebers
Alle in diesem Artikel geäußerten Aussagen sind ausschließlich die der Autoren und spiegeln nicht notwendigerweise die Aussagen ihrer verbundenen Organisationen oder des Herausgebers, der Herausgeber und der Gutachter wider. Für die in diesem Artikel bewerteten Produkte oder die Aussagen des Herstellers wird vom Herausgeber weder eine Garantie noch eine Unterstützung übernommen.
Verweise
- 1. Control UCFD . (2024) Klinischer Überblick über ME/CFS. Online verfügbar unter: https://www.cdc.gov/me-cfs/hcp/clinical-overview .
- 2. (US) IoM . (2015) Jenseits der Myalgischen Enzephalomyelitis/des Chronischen Erschöpfungssyndroms: Eine Krankheit neu definieren. Online verfügbar unter: https://www.ncbi.nlm.nih.gov/pubmed/26126237 (Zugriff 7, 2015)
- 3. Lawson N, Hsieh CH, March D, Wang X. Erhöhte Energieproduktion bei Patienten mit chronischem Erschöpfungssyndrom. J Nat Sci. (2016) 2. doi: 10.1016/S0091-679X(06)80007-5 [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 4. Paul BD, Lemle MD, Komaroff AL, Snyder SH. Redox-Ungleichgewicht verbindet COVID-19 und myalgische Enzephalomyelitis/chronisches Erschöpfungssyndrom. Proc Natl Acad Sci USA. (2021) 118:8118. doi: 10.1073/pnas.2024358118 [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 5. Morris G, Maes M. Erhöhter nukleärer Faktor-kappaB und Verlust von p53 sind Schlüsselmechanismen bei Myalgischer Enzephalomyelitis/Chronischem Erschöpfungssyndrom (ME/CFS). Med Hypotheses. (2012) 79:607–13. doi: 10.1016/j.mehy.2012.07.034 [ DOI ] [ PubMed ] [ Google Scholar ]
- 6. Filler K, Lyon D, Bennett J, McCain N, Elswick R, Lukkahatai N, et al. Zusammenhang zwischen mitochondrialer Dysfunktion und Müdigkeit: eine Literaturübersicht. BBA Clin. (2014) 1:12–23. doi: 10.1016/j.bbacli.2014.04.001, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 7. Brown AE, Jones DE, Walker M, Newton JL. Anomalien der AMPK-Aktivierung und Glukoseaufnahme in kultivierten Skelettmuskelzellen von Personen mit chronischem Erschöpfungssyndrom. PLoS One. (2015) 10:e0122982. doi: 10.1371/journal.pone.0122982, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 8. Fisicaro F, Di Napoli M, Liberto A, Fanella M, Di Stasio F, Pennisi M, et al. Neurologische Folgen bei Patienten mit COVID-19: eine histopathologische Perspektive. Int J Environ Res Public Health. (2021) 18:1415. doi: 10.3390/ijerph18041415, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 9. Cash A, Kaufman DL. Oxalacetat-Behandlung bei geistiger und körperlicher Erschöpfung bei Patienten mit Myalgischer Enzephalomyelitis/Chronischem Erschöpfungssyndrom (ME/CFS) und Long-COVID-Erschöpfung: eine nicht randomisierte kontrollierte klinische Studie. J Transl Med. (2022) 20:295. doi: 10.1186/s12967-022-03488-3, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 10. Wiese EK, Hitosugi S, Loa ST, Sreedhar A, Andres-Beck LG, Kurmi K, et al. Die enzymatische Aktivierung der Pyruvatkinase erhöht das zytosolische Oxalacetat, um den Warburg-Effekt zu hemmen. Nat Metab. (2021) 3:954–68. doi: 10.1038/s42255-021-00424-5, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 11. Ijare O, Conway D, Cash A, Baskin D, Pichumani K. CBMT-49. Oxalacetat verändert den Glukosestoffwechsel beim Glioblastom: 13C ISOTOPOMER-Studie. Neuro-Onkologie. (2019) 21:vi43–4. doi: 10.3390/ijms24119137 [ DOI ] [ Google Scholar ]
- 12. Nogueira L. Akute Oxalacetat-Exposition erhöht die Ermüdungsresistenz im Soleus-Muskel von Mäusen in vitro. FASEB J. (2011) 25:1104. doi: 10.1096/fasebj.25.1_supplement.1104.5 [ DOI ] [ Google Scholar ]
- 13. Germain A, Ruppert D, Levine SM, Hanson MR. Stoffwechselprofilierung einer Kohorte mit Patienten mit myalgischer Enzephalomyelitis und chronischem Erschöpfungssyndrom zeigt Störungen im Fettsäure- und Lipidstoffwechsel. Mol BioSyst. (2017) 13:371–9. doi: 10.1039/C6MB00600K, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 14. Chalder T, Berelowitz G, Pawlikowska T, Watts L, Wessely S, Wright D, et al. Entwicklung einer Ermüdungsskala. J Psychosom Res. (1993) 37:147–53. doi: 10.1016/0022-3999(93)90081-P [ DOI ] [ PubMed ] [ Google Scholar ]
- 15. Frisk B, Jurgensen M, Espehaug B, Njøten KL, Søfteland E, Aarli BB, et al. Eine sichere und effektive, auf Mikroentscheidungen basierende Rehabilitation für Patienten mit Long COVID: Ergebnisse einer quasi-experimentellen Studie. Sci Rep. (2023) 13:9423. doi: 10.1038/s41598-023-35991-y, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 16. Mc NQ. Beachten Sie den Stichprobenfehler der Differenz zwischen korrelierten Anteilen oder Prozentsätzen. Psychometrika. (1947) 12:153–7. doi: 10.1007/BF02295996 [ DOI ] [ PubMed ] [ Google Scholar ]
- 17. Gladwell P, Harland M, Adrissi A, Kershaw S, Dures E. Untersuchung der Inhaltsvalidität der Chalder-Fatigue-Skala mittels kognitiver Interviews bei einer ME/CFS-Population. Fatigue: Biomed, Health Behav. (2024) 12:217–37. doi: 10.1080/21641846.2024.2335861 [ DOI ] [ Google Scholar ]
- 18. Dowling NM, Bolt DM, Deng S, Li C. Messung und Kontrolle von Verzerrungen in patientenberichteten Ergebnissen mithilfe der multidimensionalen Item-Response-Theorie. BMC Med Res Methodol. (2016) 16:63. doi: 10.1186/s12874-016-0161-z, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 19. Lien K, Johansen B, Veierod MB, Haslestad AS, Bøhn SK, Melsom MN, et al. Abnormale Laktatansammlung im Blut während wiederholter Belastungstests bei myalgischer Enzephalomyelitis/chronischem Müdigkeitssyndrom. Physiol Rep. (2019) 7:e14138. doi: 10.14814/phy2.14138, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 20. Wilkins HM, Harris JL, Carl SM, EL, Lu J, Eva Selfridge J, et al. Oxalacetat aktiviert die mitochondriale Biogenese im Gehirn, verbessert den Insulinweg, reduziert Entzündungen und stimuliert die Neurogenese. Hum Mol Genet. (2014) 23:6528–41. doi: 10.1093/hmg/ddu371 [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 21. Williams DS, Cash A, Hamadani L, Diemer T. Oxalacetat-Supplementierung erhöht die Lebensdauer in Caenorhabditis elegans über einen AMPK/FOXO-abhängigen Signalweg. Aging Cell. (2009) 8:765–8. doi: 10.1111/j.1474-9726.2009.00527.x, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 22. Haslam JM, Krebs HA. Die Permeabilität von Mitochondrien für Oxalacetat und Malat. Biochem J. (1968) 107:659–67. doi: 10.1042/bj1070659, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 23. Booth NE, Myhill S, McLaren-Howard J. Mitochondriale Dysfunktion und die Pathophysiologie der Myalgischen Enzephalomyelitis/des Chronischen Erschöpfungssyndroms (ME/CFS). Int J Clin Exp Med. (2012) 5:208–20. [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 24. Brown AE, Dibnah B, Fisher E, Newton JL, Walker M. Pharmakologische Aktivierung von AMPK und Glukoseaufnahme in kultivierten menschlichen Skelettmuskelzellen von Patienten mit ME/CFS. Biosci Rep. (2018) 38:242. doi: 10.1042/BSR20180242, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 25. Yoshikawa K. Studien zur antidiabetischen Wirkung von Natriumoxalacetat. Tohoku J Exp Med. (1968) 96:127–41. doi: 10.1620/tjem.96.127 [ DOI ] [ PubMed ] [ Google Scholar ]
- 26. Vidoni ED, Choi IY, Lee P, Reed G, Zhang N, Pleen J, et al. Sicherheits- und Zielbindungsprofil von zwei Oxalacetat-Dosen bei Alzheimer-Patienten. Alzheimer-Demenz. (2020) 17:7–17. doi: 10.1002/alz.12156 [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 27. Desagher S, Glowinski J, Premont J. Pyruvat schützt Neuronen vor durch Wasserstoffperoxid verursachter Toxizität. J Neurosci. (1997) 17:9060–7. doi: 10.1523/JNEUROSCI.17-23-09060.1997, PMID: [ DOI ] [ PMC-Freier Artikel ] [ PubMed ] [ Google Scholar ]
- 28. Puntel RL, Nogueira CW, Rocha JB. Krebs-Zyklus-Zwischenprodukte modulieren die Produktion von Thiobarbitursäure-reaktiven Spezies (TBARS) im Rattenhirn in vitro . Neurochem Res. (2005) 30:225–35. doi: 10.1007/s11064-004-2445-7, PMID: [ DOI ] [ PubMed ] [ Google Scholar ]
- 29. Yamamoto HA, Mohanan PV. Wirkung von Alpha-Ketoglutarat und Oxalacetat auf mitochondriale DNA-Schäden im Gehirn und durch Kainsäure induzierte Krampfanfälle bei Mäusen. Toxicol Lett. (2003) 143:115–22. doi: 10.1016/S0378-4274(03)00114-0 [ DOI ] [ PubMed ] [ Google Scholar ]
Zugehörige Daten
In diesem Abschnitt werden alle in diesem Artikel enthaltenen Datenzitate, Datenverfügbarkeitserklärungen oder ergänzenden Materialien gesammelt.
Datenverfügbarkeitserklärung
Die in dieser Studie vorgestellten Datensätze sind in Online-Repositorien verfügbar. Die Namen der Repositorien und die Zugangsnummern finden Sie unter: https://doi.org/10.7910/DVN/KBCE6H .