
Klinische Studie: Oxalacetat-Behandlung bei geistiger und körperlicher Erschöpfung bei Patienten mit Myalgischer Enzephalomyelitis/Chronischem Erschöpfungssyndrom (ME/CFS) und Long-COVID-Erschöpfung: eine nicht randomisierte kontrollierte klinische Studie
Aktie
Eine von Experten begutachtete und im Journal of Translational Medicine, einer Springer/Nature-Publikation, veröffentlichte klinische Studie berichtet von einer signifikanten Verringerung der geistigen und körperlichen Erschöpfung bei Patienten mit Myalgischer Enzephalomyelitis/Chronischem Erschöpfungssyndrom (ME/CFS) und Long COVID durch die orale Verabreichung von wasserfreiem Enol-Oxalacetat (Oxalacetat CFS), einem medizinischen Nahrungsmittel.
-
Die Studie umfasste eine sechswöchige Behandlung mit Oxalacetat unter Anwendung einer Dosissteigerungsmethode von 500 mg zweimal täglich bis 1.000 mg dreimal täglich.
-
Zu den Studienteilnehmern gehörten ME/CFS-Patienten, deren Diagnose im Durchschnitt seit 8,9 Jahren besteht, sowie Long-COVID-Patienten mit Symptomen seit mindestens 6 Monaten.
-
ME/CFS-Patienten erhielten Oxalacetat-Dosen von entweder 500 Milligramm zweimal täglich, 1.000 Milligramm zweimal täglich oder 1.000 Milligramm dreimal täglich.
-
Die Verringerung der Müdigkeit war dosisabhängig, wobei die niedrigste Dosis innerhalb von sechs Wochen zu einer Verringerung der Müdigkeit um 21,7 % und die höchste Dosis zu einer Verringerung um 33,3 % führte.
-
-
Long-COVID-Patienten erhielten entweder zweimal täglich 500 Milligramm oder zweimal täglich 1000 Milligramm Oxalacetat.
-
Die Müdigkeit bei Long-COVID-Patienten verringerte sich in sechs Wochen um bis zu 46,8 %.
Abstrakt
Hintergrund
Es gibt keine zugelassene pharmazeutische Behandlung für Myalgische Enzephalomyelitis/Chronisches Erschöpfungssyndrom (ME/CFS). Die Erschöpfung dieser Patienten kann Jahrzehnte anhalten. Long COVID kann zu ME/CFS führen, und derzeit wird geschätzt, dass bis zu 20 Millionen Amerikaner nach COVID erhebliche Symptome haben, wobei Erschöpfung das häufigste Symptom ist. Wasserfreies Enol-Oxalacetat (AEO), ein Nahrungsergänzungsmittel, lindert Berichten zufolge körperliche und geistige Erschöpfung und ist bei ME/CFS-Patienten vermindert. Hier untersuchen wir die Verwendung von höher dosiertem AEO als medizinisches Nahrungsmittel zur Linderung pathologischer Erschöpfung.
Methoden
ME/CFS- und Long-COVID-Patienten wurden in eine offene, nicht randomisierte, kontrollierte „Proof of Concept“-Studie mit 500 mg AEO-Kapseln eingeschlossen. Die Kontrolle erfolgte durch eine historische ME/CFS-Müdigkeitsstudie und eine unterstützende Metaanalyse. Diese zeigte eine durchschnittliche Verbesserung von 5,9 % gegenüber dem Ausgangswert unter oraler Placebogabe auf der Chalder-Skala. Zu Beginn waren 73,7 % der ME/CFS-Patienten Frauen, das Durchschnittsalter lag bei 47 Jahren, und die Dauer des ME/CFS seit der Diagnose betrug 8,9 Jahre . Die Long-COVID-Patienten waren eine zufällig ausgewählte Gruppe, die mindestens sechs Monate lang auf Werbung in sozialen Medien (Facebook) mit Symptomen reagierte. ME/CFS-Patienten erhielten sechs Wochen lang getrennte Dosen von 500 mg BID (N = 23), 1.000 mg BID (N = 29) und 1.000 mg TID (N = 24) AEO. Long-COVID-Patienten erhielten 500 mg AEO BID (N = 22) und 1.000 mg AEO (N = 21), ebenfalls über einen Zeitraum von sechs Wochen. Das wichtigste Ergebnismaß war der Vergleich des Ausgangswerts mit den Ergebnissen nach sechs Wochen mit dem Chalder Fatigue Score (Likert-Score) gegenüber einem historischen Placebo. Die zu testende Hypothese wurde vor der Datenerhebung formuliert.
Ergebnisse
76 ME/CFS-Patienten (73,7 % Frauen, Durchschnittsalter 47 Jahre) zeigten nach 6 Wochen eine durchschnittliche Verringerung der Müdigkeit um 22,5 % bis 27,9 % gegenüber dem Ausgangswert (P < 0,005) (Likert-Bewertung), gemessen mit dem „Chalder Fatigue Questionnaire“. Sowohl die körperliche als auch die geistige Müdigkeit waren gegenüber dem Ausgangswert und dem historischen Placebo signifikant verbessert. Die Müdigkeitslinderung bei ME/CFS-Patienten nahm dosisabhängig von 21,7 % bei 500 mg BID über 27,6 % bei 1000 mg Oxalacetat BID auf 33,3 % bei 1000 mg TID zu. Die Müdigkeit von Long-COVID-Patienten wurde innerhalb von 6 Wochen signifikant um bis zu 46,8 % reduziert.
Schlussfolgerungen
Bei ME/CFS- und Long-COVID-Patienten zeigte sich nach sechswöchiger Behandlung eine signifikante Verringerung der körperlichen und geistigen Erschöpfung. Da bei der Linderung der Erschöpfung bei Millionen von ME/CFS- und Long-COVID-Patienten bisher kaum Fortschritte erzielt wurden, könnte wasserfreies Enoloxalacetat diesen wichtigen medizinischen Bedarf decken. Weitere Studien zur Oxalacetat-Supplementierung zur Behandlung von ME/CFS und Long-COVID sind erforderlich.
Testregistrierung https://clinicaltrials.gov/ct2/show/NCT04592354 Registriert am 19. Oktober 2020.
Grafische Zusammenfassung
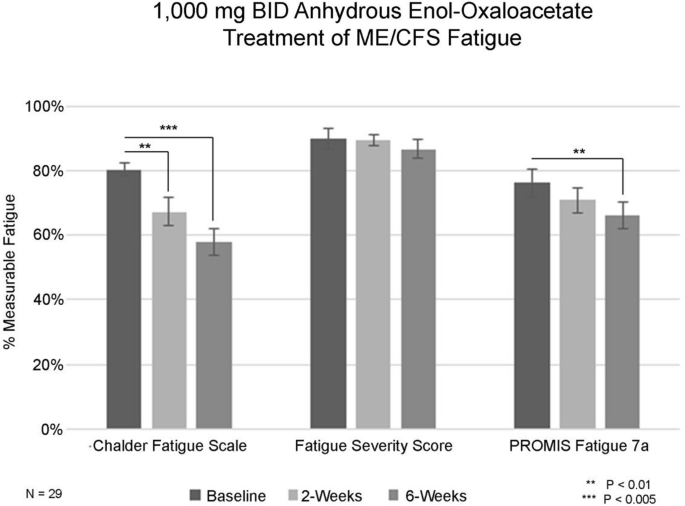
1.000 mg BID Normalisierte Müdigkeitsdaten für den Ausgangswert sowie für 2 Wochen und 6 Wochen, ausgewertet anhand von 3 validierten Fragebögen zur Müdigkeitsbewertung
Wichtige Punkte
Frage: Kann die Normalisierung des Stoffwechsels mit Oxalacetat dazu beitragen, die Müdigkeit bei ME/CFS und Long COVID zu reduzieren?
Ergebnisse: Bei Patienten mit ME/CFS und Long-COVID, die mit oralen wasserfreien Enol-Oxalacetat-Kapseln behandelt wurden, kam es innerhalb von 6 Wochen zu einer hochsignifikanten Verringerung der körperlichen und geistigen Erschöpfung.
Bedeutung: Pathologische Müdigkeit ist ein unbehandeltes medizinisches Problem, das bei ME/CFS, Long-COVID und anderen Krankheiten weit verbreitet ist. Hier hat die Behandlung zur Normalisierung des Stoffwechsels mit wasserfreiem Enol-Oxalacetat erstmals Verbesserungen bei pathologischer Müdigkeit gezeigt.
Hintergrund
Physiologische Müdigkeit ist den meisten Menschen bekannt und wird in erster Linie durch körperliche Anstrengung verursacht [ 1 ]. Sie kann aber auch durch Schlafmangel oder längeres Wachsein, einen gestörten zirkadianen Rhythmus oder eine erhöhte Arbeitsbelastung verursacht werden [ 2 ]. Im Gegensatz dazu ist pathologische Müdigkeit oder pathologische Erschöpfung mehr als nur Müdigkeit [ 3 ] und bezeichnet körperliche und geistige Erschöpfung, die durch virale oder bakterielle Infektionen, Traumata, Krankheiten, Überarbeitung, Übertraining oder epigenetische oder genetische Veränderungen verursacht werden kann. Diese führen zu körperlicher und geistiger Erschöpfung, die sich durch Bettruhe nicht bessert und durch körperliche oder geistige Aktivität verschlimmert werden kann.
Physiologische Müdigkeit wird durch neurologische Veränderungen, Veränderungen des Kalziumspiegels, der Durchblutung und des Sauerstoffgehalts, reduzierte ATP-Energiespiegel und Glykogenspiegel sowie einen Anstieg intrazellulärer Metabolite wie H + , Laktat, Pi und ROS verursacht [ 4 ]. Am wichtigsten ist, dass diese physiologischen Veränderungen durch Ruhe rückgängig gemacht werden.
Im Gegensatz dazu kann pathologische Müdigkeit zwar einige der gleichen physiologischen Veränderungen mit sich bringen wie physiologische Müdigkeit, es treten jedoch zahlreiche zusätzliche Stoffwechselveränderungen auf, darunter Veränderungen der Energieproduktionswege, des Redoxpotentials der Zellen, Entzündungsreaktionen, mitochondriale Fehlfunktionen, eine verringerte AMPK-Aktivierung (und die damit verbundene Glukoseaufnahme ins Gewebe) sowie ein reduzierter Vitamin-D-Spiegel bei älteren Menschen [ 5 ]. Anders als bei physiologischer Müdigkeit lassen sich die Stoffwechselveränderungen bei pathologischer Müdigkeit durch Ruhe nicht rückgängig machen, und die Müdigkeit kann beispielsweise noch lange anhalten, nachdem das Virus besiegt, die bakterielle Invasion zurückgeschlagen oder das geschädigte Gewebe repariert wurde [ 6 ].
Konkrete Beispiele hierfür sind die Erkrankungen Myalgische Enzephalomyelitis/Chronisches Erschöpfungssyndrom (ME/CFS) und „Long COVID“. Es gibt viele Stoffwechselveränderungen, die ME/CFS und Long COVID miteinander in Verbindung bringen [ 7 ], und tatsächlich kann eine COVID-Infektion zu einer Diagnose von ME/CFS führen [ 8 ].
Physiologische Muskelermüdung lässt sich leicht durch Ruhe heilen, da die Muskeln dann Nährstoffe aufnehmen und Abfallprodukte wie Laktat durch normale Zellprozesse abtransportiert werden können. Im Gegensatz dazu erholen sich bei pathologischer Ermüdung aufgrund von Schäden – sei es durch virale oder bakterielle Infektionen, Traumata, Krankheiten oder andere Zellangriffe – die Veränderungen des Zellstoffwechsels nicht immer, nachdem sie Energie für die Abwehr/Reparatur des Körpers bereitgestellt haben [ 6 ]. Wenn sich der Stoffwechsel nicht normalisiert, führt dies zu anhaltender geistiger und körperlicher Ermüdung, die jahrelang anhalten kann, selbst nachdem die ursprüngliche Schädigung des Körpers abgeklungen ist.
Stoffwechselveränderungen bei ME/CFS
Durch die Schädigung des Körpers werden verschiedene Stoffwechselmechanismen aktiviert, und diese anhaltenden Stoffwechselveränderungen können dauerhafte Müdigkeit verursachen, wenn sie nicht auf den ursprünglichen normalen Stoffwechselzustand zurückprogrammiert werden. Naviaux et al. vermuten, dass diese Veränderungen aufgrund der „Zellgefahrenreaktion“ charakteristisch für den „Dauer“-Zustand sind [ 5 ]. Eine solche Stoffwechselveränderung ist die erhöhte Glykolyse im Zytoplasma der Zelle. Diese Stoffwechselverschiebung wurde erstmals in den 1930er Jahren von Otto Warburg beschrieben und als „Warburg-Effekt“ bezeichnet. Warburg beschrieb die metabolische Energieverschiebung in Bezug auf Krebszellen, und tatsächlich weisen fast alle Krebsarten diese Veränderung im Energiestoffwechsel auf. Otto Warburg dachte, dass die Zelle, sobald sie auf diese andere Energieproduktionsmethode umgestellt hat, nicht mehr in eine normale Zelle zurückverwandelt werden kann. Diese Änderung des Energiepfads kann zu pathologischer Müdigkeit führen [ 9 ].
Der Warburg-Effekt tritt nicht nur in Krebszellen auf, sondern ist auch in adaptiven Immunzellen myeloider und lymphatischer Abstammung zu beobachten und zeichnet sich durch eine Umstellung auf aerobe Glykolyse aus [ 10 ]. Der Warburg-Effekt tritt auch bei der Replikation von Viren wie MERS-CoV und SARS-CoV-2 auf [ 11 ]. Klinische Arbeiten an ME/CFS-Patienten zeigen diese Veränderung des Warburg-Effekt-Stoffwechsels, wodurch der größte Teil des Energieträgers ATP aus nicht-mitochondrialen Quellen erzeugt wird [ 12 ].
Eine weitere Stoffwechselveränderung, die bei erschöpften Patienten beobachtet wird, ist der Rückgang von NAD + /NADH im Zytoplasma [ 7 ]. NAD + -Spiegel in der Zelle fungieren als Signalmolekül, um bestimmte Stoffwechselzustände zu steuern. Beim Menschen sinkt der NAD + -Spiegel mit zunehmender Muskelbeanspruchung. Graham et al. (1978) fanden beispielsweise heraus, dass der NAD + -Spiegel in der Muskulatur bei Belastung zwischen 65 % und 100 % der maximalen Sauerstoffaufnahme (V̇ o 2 max ) sinkt, und obwohl ein erhöhter Muskelwasserspiegel für Bei etwa 73 % dieses Rückgangs waren die NAD+-Werte auch bei der Messung des Trockengewichts noch immer reduziert [ 13 ]. Auch die NADH-Werte stiegen an [ 14 ], was das NAD+/NADH-Verhältnis weiter senkte. Im Gegensatz zu normalen Patienten berechneten Sweetman et al. (2020), dass die NADH-Werte in den mononukleären Zellen des peripheren Blutes bei Patienten mit ME/CFS höher sind [ 15 ].
Eine weitere Stoffwechselveränderung als Reaktion auf zellulären Stress/Zellschäden ist die Translokation des Proteinkomplexes NF-kB vom Zytoplasma in den Zellkern. Diese Reaktion ist zwar für unsere Gesundheit entscheidend, bei manchen Menschen, wie beispielsweise bei COVID-19-Patienten mit Langzeitsymptomen, lässt sie sich jedoch nicht unterbrechen, sodass die Energie der Zelle ständig für die Immunreaktion gebunden ist [ 16 ]. Diese Veränderung des Entzündungsverlaufs in einen chronischen Zustand kann zu anhaltender Müdigkeit führen und ist bei Erkrankungen zu beobachten, bei denen Müdigkeit eine häufige Determinante ist [ 17 , 18 , 19 ].
Mitochondrien sind Organellen, die während der normalen Zellfunktion den Großteil der Energie produzieren. Erhöhter Energiebedarf zur Bekämpfung von Infektionen und zur Reparatur von Gewebe kann die Produktion reaktiver Sauerstoffspezies (ROS) in den Mitochondrien erhöhen und so die mitochondriale Funktion schädigen. Mitochondriale Fehlfunktionen werden bei ME/CFS-Patienten vermutet [ 20 ].
Eine weitere Stoffwechselveränderung, die als Reaktion auf zellulären Stress/Schäden auftritt, ist die verminderte Aktivierung des AMPK-Proteins und eine daraus resultierende Verringerung der Glukoseaufnahme durch das Gewebe. Dies lässt sich direkt in Zellen von ME/CFS-Patienten beobachten [ 21 ]. Eine Verringerung des zur Energieversorgung der Zelle verfügbaren Glukosebrennstoffs kann eine direkte Ursache für Müdigkeit sein.
Fisicaro et al. stellen fest, dass ME/CFS-Patienten und Long-COVID-Patienten neuropathophysiologische Veränderungen gemeinsam haben, die die Produktion schädlicher reaktiver Sauerstoffspezies verstärken, wahrscheinlich aufgrund der Reaktion des Wirts auf die Erstinfektion [ 22 ] (Tabelle 1 ).
Diese sechs Stoffwechselveränderungen, die bei ME/CFS-Patienten beobachtet werden, unterscheiden sich von denen, die bei normalen Kontrollpersonen mit physiologischer Erschöpfung zu beobachten sind.
Eine Methode zur Verringerung der Müdigkeit könnte darin bestehen, diese zellulären, dysfunktionalen Stoffwechselveränderungen anzugehen und sie wieder in Richtung Normalfunktion zu bewegen. Oxalacetat, ein menschlicher Energiemetabolit, erhöht nachweislich die Muskelausdauer und reduziert die Muskelermüdung in normalen Zellen, deren Ermüdung durch Muskelüberbeanspruchung mittels elektrischem Strom, der an den Muskel angelegt wird, stimuliert wird [ 23 ]. Interessanterweise deuten metabolomische Studien an ME/CFS-Patienten im Vergleich zu normalen Kontrollpersonen darauf hin, dass der Oxalacetatspiegel im Plasma von ME/CFS-Patienten signifikant reduziert ist [ 24 ]. Aufgrund der Ähnlichkeit zwischen ME/CFS und Long COVID wurde diese Studie auf Patienten mit Müdigkeit nach einer COVID-Erkrankung ausgeweitet.
Begründung dieser Studie
Diese Studie wurde durchgeführt, da ein medizinischer Bedarf für die Behandlung der pathologischen Müdigkeit bei ME/CFS und Long-COVID besteht.
Ziel dieser Studie
Um zu sehen, ob wasserfreies Enoloxalacetat (AEO) die körperliche und geistige Erschöpfung bei ME/CFS- und Long-COVID-Patienten reduzieren kann.
Experimentelle Hypothese dieser Studie
AEO hat sich als wirksam erwiesen, um viele Stoffwechselstörungen zu verändern, die auch bei ME/CFS- und Long-COVID-Patienten auftreten, sowie einen Mangel im Blutserum von ME/CFS-Patienten. Die Normalisierung des Stoffwechsels mit oralem AEO kann die Müdigkeit bei dieser Patientengruppe umkehren.
Methoden
ME/CFS-Patienten, die die Fukuda-Definition [ 25 ] erfüllten, sich bereit erklärten, eine sechswöchige Behandlung mit wasserfreiem Enoloxalacetat zu absolvieren und drei validierte Online-Umfragen zum Thema Müdigkeit auszufüllen, wurden aus dem bestehenden Patientenstamm der Autoren ausgewählt und zur Teilnahme an dieser Studie eingeladen. Long-COVID-Patienten, die mindestens sechs Monate lang unter Müdigkeit litten und vorher keine Müdigkeit aufwiesen, wurden über soziale Medien rekrutiert. Die Patienten absolvierten diese Studie zu Hause.
Die Patienten füllten zunächst validierte Online-Fragebögen zur Erschöpfung aus, darunter den Chalder Fatigue Questionnaire [ 26 ], den Fatigue Severity Score [ 27 ] und den PROMIS Short Form Fatigue 7A Fragebogen [ 28 ]. Die Erschöpfungsbefragungen wurden für jede Gruppe nach zwei und sechs Wochen wiederholt. Alle unerwünschten Ereignisse wurden dokumentiert. Die Ergebnisse der Erschöpfungsbefragungen wurden anschließend auf statistische Signifikanz analysiert. Da es sich um eine „Proof of Concept“-Studie handelte, umfassten die Stichprobengruppen ca. 23 Teilnehmer.
Nachdem die Ausgangswerte der Erschöpfung über Online-Fragebögen ermittelt worden waren, erhielten die Teilnehmer sechs Wochen lang zweimal täglich 500 mg wasserfreies Enoloxalacetat (AEO) in Kapseln. Nach Überprüfung möglicher Nebenwirkungen, die die Sicherheit zeigten, wurde die Dosis in der nächsten Patientengruppe für sechs Wochen auf zweimal täglich 1000 mg AEO erhöht. Nach Überprüfung der Sicherheit der zweimal täglich 1000 mg AEO-Dosis wurde die Dosis der nächsten Patientengruppe schließlich auf dreimal täglich 1000 mg erhöht. Es wurden keine Anreize geboten.
In dieser einfachen Studie wurde keine Stratifizierung der Gruppen vorgenommen. Es wurde eine Dosissteigerung vorgenommen, wobei neue Studienteilnehmer der aktuellen oder nächsthöheren Dosisgruppe zugeteilt wurden. Eine Verblindung erfolgte nicht. Die kleinste Einheit, die zur Beurteilung der Interventionseffekte analysiert wird, ist eine Gruppe von 21 Patienten.
Die Ermüdungswerte wurden als Mittelwerte zusammengefasst und Standardabweichungen, Standardfehler und Konfidenzintervalle berechnet. Veränderungen wurden als Effektstärken zusammengefasst und auf eine Skala von 0–100 % normiert, wobei 100 % den höchsten mit dem Erhebungsinstrument messbaren Ermüdungsgrad darstellt. Die Signifikanz wurde anhand der T-Test-Ergebnisse der Studierenden in Excel durch Vergleich mit dem Ausgangswert berechnet. Die klinische Signifikanz wurde durch eine Reduktion des Chalder-Ermüdungswerts auf vier oder weniger mittels bimodaler Bewertung und durch eine insgesamt signifikante Reduktion der Ermüdung in allen Tests gemessen.
Es wurde ein Vergleich mit einer historischen Placebogruppe angestellt, die ebenfalls den Chalder Fatigue Score verwendete und ein orales Placebo erhielt. Wearden et al. verwendeten in einer randomisierten, placebokontrollierten Studie eine orale Kapsel. 34 Patienten erhielten ein Placebo, 5 brachen die Studie ab. Nur zwei Patienten (5,9%) der Patienten, die die Studie nicht abbrachen, zeigten eine klinische Verbesserung im Chalder Fatigue Questionnaire [ 29 ].
Während der Autor Dr. Kaufman aufgrund seiner spezialisierten Praxis Zugang zu vielen ME/CFS-Patienten hatte und die Rekrutierung für den ME/CFS-Teil der klinischen Studie schnell abgeschlossen war, gehörten Long-COVID-Patienten nicht zu seiner Praxis. Die Teilnehmer für die Long-COVID-Studie wurden über Facebook-Werbung rekrutiert, nachdem sie die Rekrutierungskriterien erfüllt hatten. Dazu gehörten der Nachweis einer ersten COVID-Infektion, der Nachweis einer Remission der COVID-Infektion, keine Müdigkeit vor der COVID-Infektion und anhaltende Müdigkeit für mindestens sechs Monate nach der COVID-Infektion.
Alle Patienten dieser Studie haben die Einwilligungserklärungen schriftlich akzeptiert und erklärt, dass diese erste „Proof of Concept“-Studie unverblindet war.
Ergebnisse
Der Teilnehmerfluss für diese Studie ist im beigefügten Diagramm dargestellt. Die Rekrutierung begann im März 2021 und dauerte bis Februar 2022.
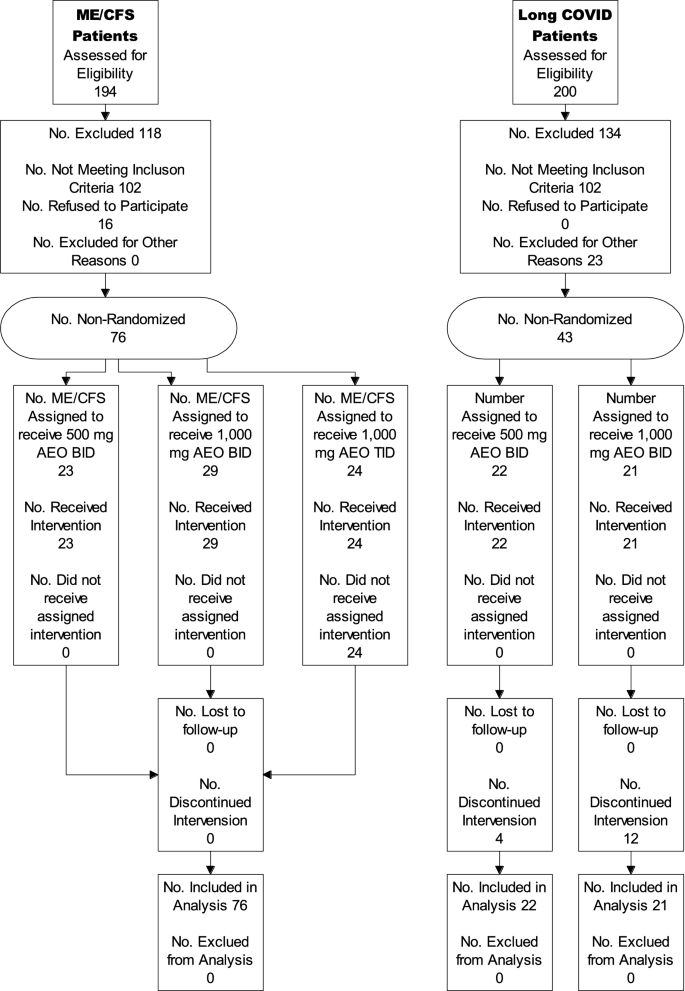
Bei der klinischen Studie handelt es sich um eine offene, dosiseskalierende „Proof of Concept“-Studie zur Anwendung von wasserfreiem Enoloxalacetat zur Behandlung von Müdigkeit. Sie wurde zunächst mit ME/CFS-Patienten durchgeführt und aufgrund der Ähnlichkeiten der beiden Erkrankungen auf Long-COVID-Patientengruppen ausgeweitet.
Die Ausgangserschöpfung vor der Behandlung wurde mit der Chalder Fatigue Scale, der Fatigue Severity Scale und dem PROMIS–Fatigue-Short Form 7a ermittelt. Die Werte wurden als Mittelwert zusammengefasst und Standardabweichungen, Standardfehler und Konfidenzintervalle berechnet. Veränderungen werden auch als Effektstärken zusammengefasst und auf eine Skala von 0–100 % normiert, wobei 100 % der höchste mit dem Erhebungsinstrument messbare Erschöpfungsgrad ist. Die Dosisfindung erfolgte mit der ersten Patientengruppe, die zweimal täglich 500 mg wasserfreies Enoloxalacetat erhielt, die zweite Gruppe zweimal täglich 1000 mg wasserfreies Enoloxalacetat und die dritte Gruppe von ME/CFS-Patienten dreimal täglich 1000 mg wasserfreies Enoloxalacetat. Die Long-COVID-Patienten erhielten zweimal täglich 500 mg wasserfreies Enoloxalacetat und dann zweimal täglich 1000 mg wasserfreies Enoloxalacetat.
Ein historischer Placeboeffekt bei ME/CFS-Patienten wurde als Vergleichsgröße für die in diesen Studien gewonnenen Daten herangezogen. Die historischen Placebodaten zeigten eine Verbesserung des Chalder Fatigue Scores (Likert-Score) um 5,9 % gegenüber dem Ausgangswert unter oraler Intervention mit Placebo über einen Zeitraum von 26 Wochen. Es wird darauf hingewiesen, dass der Placeboeffekt bei ME/CFS-Patienten laut einer Metaanalyse von ME/CFS-Behandlungsstudien gering ist [ 29 ].
Zunächst wurden insgesamt 76 Männer und Frauen im Alter von 18 bis 72 Jahren mit ME/CFS für die klinische Studie ausgewählt. Weitere 43 Patienten mit Long COVID wurden als zusätzliche Studienarme hinzugefügt. Da Frauen viel häufiger an ME/CFS erkranken, sind die meisten ME/CFS-Patienten Frauen (73,7 %). Die durchschnittliche Dauer, die ein Patient an ME/CFS leidet, beträgt 8,9 Jahre, und die durchschnittlichen Ausgangswerte für Erschöpfung liegen zwischen 76 und 92 % der maximal messbaren Erschöpfung für die Gruppe (Chalder-Erschöpfungsskala, Likert-Bewertung). Die Chalder-Erschöpfungsskala wird häufig verwendet, um ME/CFS-Erschöpfung zu messen. Sie kann nach der „Likert“-Methode bewertet werden, wobei pro Frage ein Punktebereich von 0 bis 4 Punkten zugewiesen wird, oder sie kann „bimodal“ bewertet werden, wobei „0“ für normale Erschöpfung und „1“ für hohe Erschöpfung steht. Nach einer sechswöchigen Behandlung mit 500 mg wasserfreiem Enoloxalacetat verringerte sich bei 5 von 23 Patienten (21,7 %) ihre messbare Müdigkeit auf einen Wert von 4 oder weniger (bimodale Bewertung), was auf eine Rückkehr der bei ME/CFS auftretenden Müdigkeit zu einem „normalen“ Müdigkeitsniveau hindeutet. Da die durchschnittliche Dauer der ME/CFS-Erkrankung in dieser Gruppe über 6 Jahre betrug, ist es sehr vielversprechend, dass > 23 % der Teilnehmer nach 6-wöchiger Behandlung zu einem normalen Müdigkeitsniveau zurückkehren. In der Behandlungsgruppe mit 1000 mg AEO BID sank die Müdigkeit bei 8 von 29 Patienten (27,6 %) auf 4 oder weniger auf der bimodalen Müdigkeitsskala von Chalder. Bei einer Erhöhung der Dosis auf 1000 mg TID sank der Müdigkeitswert bei 8 von 24 Patienten (33,3 %) auf 4 oder weniger Eine Verringerung der Müdigkeit war auch bei längerer Einnahmezeit zu beobachten, wobei sich die Wirkung nach 6 Wochen gegenüber 2 Wochen verbesserte.
Mithilfe der Likert-Bewertung in der Chalder-Fatigue-Skala zeigte sich in der Long-COVID-Gruppe, die zweimal täglich 500 mg erhielt, innerhalb von 6 Wochen eine hochsignifikante Verringerung der Erschöpfung um 22,5 % gegenüber den Ausgangswerten. Der Schweregrad sank gegenüber dem Ausgangswert hochsignifikant um 11,7 %, und der PROMIS Fatigue Short Form 7A zeigte eine nicht signifikante Verringerung der Erschöpfung um 5,9 % gegenüber dem Ausgangswert.
In der Long-COVID-Gruppe, die zweimal täglich 1000 mg erhielt, konnte die Wirksamkeit der Behandlung weiter gesteigert werden. Nach sechs Wochen reduzierte sich das Müdigkeitsniveau gegenüber dem Ausgangswert um 27,9 %. Der Schweregrad zeigte eine nicht signifikante Reduktion um 2,9 %, und der PROMIS-Fatigue-7a-Score verringerte sich innerhalb von sechs Wochen hochsignifikant um 10,0 %.
Im Vergleich zum historischen Placebo [ 29 ] stellten 75,0 % der ME/CFS-Teilnehmer (57/76) eine Verbesserung der Müdigkeit gegenüber dem Placebo-Effekt fest. 62,8 % (27/43) der Long-COVID-Patienten zeigten eine Verbesserung gegenüber dem historischen Placebo.
Nicht nur die körperliche Erschöpfung wurde verbessert, sondern auch die geistige Erschöpfung wurde sowohl bei ME/CFS-Patienten als auch bei Patienten mit Post-COVID-Erschöpfung hochsignifikant verbessert. Zu diesem Zeitpunkt wurden keine zusätzlichen Analysen durchgeführt (Tabellen 2 , 3 ).
Nebenwirkungen
In der Studie wurden keine schweren Nebenwirkungen beobachtet. Zu den nicht schwerwiegenden Nebenwirkungen zählten Dyspepsie (2/23 in der 500-mg-2-mal täglich-Gruppe und 2/24 in der 1000-mg-2-mal täglich-Gruppe) und Schlaflosigkeit (1/26 in der 500-mg-2-mal täglich-Gruppe) bei ME/CFS-Patienten. Bei den Patienten mit Long-COVID-Fatigue wurden keine schweren Nebenwirkungen beobachtet. Zu den nicht schwerwiegenden Nebenwirkungen zählten Magenverstimmung, Kopfschmerzen und Verstopfung bei 4/43 Patienten.
Diskussion
Die Ergebnisse dokumentieren eine hochsignifikante Verbesserung der Müdigkeit um 21,7–33,3 % gegenüber dem Ausgangswert durch die zusätzliche Einnahme von 500 und 1000 mg wasserfreiem Enoloxalacetat BID und TID bei ME/CFS-Patienten innerhalb von 6 Wochen. Bei Patienten mit Müdigkeit nach COVID wurden Verbesserungen von bis zu 46,8 % gegenüber dem Ausgangswert beobachtet (Chalder Fatigue Bimodal Score). Die Verbesserung bei der höheren Dosierung von 1000 mg BID bei Long-COVID-Patienten war geringer, da 9 von 22 die Studie abbrachen und die vorherigen Daten fortgeführt wurden. Ohne die Hinzufügung der Abbrecher-Scores verringerte sich die Chalder-Müdigkeit (Likert-Scoring) um 47,5 %. Die hohe Abbruchrate war wahrscheinlich auf die Rekrutierung für den COVID-Teil der Studie über soziale Medien, keine Bonuszahlung für die Beibehaltung und die tägliche Einnahme von vier Kapseln zurückzuführen.
Wir gehen davon aus, dass die Verbesserungen der Müdigkeit auf die Normalisierung gestörter Stoffwechselwege zurückzuführen sein könnten. Im Folgenden diskutieren wir verschiedene Effekte von Oxalacetat auf Stoffwechselwege, die in Studien an Menschen und Tieren identifiziert wurden, und erläutern, warum die Aufnahme von Oxalacetat über ein medizinisches Nahrungsmittel zur Linderung der Müdigkeit beitragen kann.
Abnorme Energieproduktion durch erhöhte Glykolyse im „Warburg-Effekt“
Zellen von Personen mit ME/CFS zeigen eine abweichende Energieproduktion, wobei durch erhöhte Glykolyse und Fermentation mehr Energie im Zytoplasma produziert wird [ 12 ]. Oxalacetat konnte diesen Trend in menschlichen Krebszellen umkehren und sowohl die Glykolyse als auch die Bildung von Laktat reduzieren [ 30 ]. Der „Warburg-Effekt“ bezeichnet eine Form des veränderten Zellstoffwechsels, bei dem eine spezielle Fermentation von Pyruvat zu Laktat im Zytoplasma verwendet wird, anstatt den aeroben Atmungsweg, bei dem Pyruvat in den Mitochondrien verbrannt wird und der von den meisten Körperzellen unter nicht-pathologischen Bedingungen genutzt wird. Bei Patienten mit chronischem Erschöpfungssyndrom wurde dieser alternative Energieweg nachweislich aktiviert, wodurch die Energiemenge erhöht wird, die durch Glykolyse im Zytosol produziert wird, die auch nach dem pathologischen Ereignis weiterläuft [ 12 , 31 ].
Zellen von Patienten mit Müdigkeit weisen signifikant niedrigere NAD + /NADH-Verhältniswerte auf
Oxalacetat erhöht das NAD + /NADH-Verhältnis in Tiermodellen [ 32 , 33 ], was dieses Verhältnis bei ME/CFS-Patienten in Richtung Normalisierung bringen würde. Wenn Oxalacetat in die Zelle gelangt, kann es über die Wirkung des allgegenwärtigen Enzyms Malatdehydrogenase mit dem Metaboliten „Malat“ im Zytoplasma reagieren. Im Rahmen dieser Reaktion wird NADH in NAD + umgewandelt, wodurch das NAD + /NADH-Verhältnis steigt. Krebs maß die Veränderung des NAD + /NADH-Verhältnisses durch zusätzliches Oxalacetat als 900%ige Erhöhung innerhalb von 2 Minuten [ 34 ].
NF-kB Entzündungsreduktion
Zellen von Personen mit ME/CFS zeigen eine erhöhte Aktivierung von NF-kB, was zu dauerhaft erhöhten Konzentrationen von Entzündungsproteinen führt [ 19 ]. Diese Veränderung des Entzündungswegs kann zu anhaltender Müdigkeit führen und tritt bei Erkrankungen auf, bei denen Müdigkeit eine häufige Determinante ist [ 17 , 18 , 19 ]. Oxalacetat reduzierte die Aktivierung von NF-kB in Tiermodellen um bis zu 70 % [ 32 ]. Die Verringerung der NF-kB-Überaktivierung kann zu einer signifikanten Verringerung chronischer Entzündungen und Müdigkeit führen.
Mitochondriale Schäden treten häufig bei Patienten mit Erschöpfung auf [ 35 ]
In normalen Zellen sind die Mitochondrien die „Kraftwerke“ der Zellen. Oxalacetat reguliert PGC-1alpha hoch, was wiederum die mitochondriale Biogenese aktiviert und zu einer erhöhten mitochondrialen Dichte führt [ 36 ]. Mehr Kraftwerke zur Verbrennung von Glukose und zum Ersatz defekter Mitochondrien könnten ein wichtiger Faktor bei der Verringerung von Müdigkeit sein.
Reduzierung der AMPK-Aktivierung
Zellen von Personen mit behindernder Müdigkeit zeigen eine beeinträchtigte AMPK-Aktivierung und eine beeinträchtigte Stimulation der Glukoseaufnahme [ 21 , 37 ]. AMPK ist ein Energiesensorprotein, das bei Energiemangel in normalen Zellen aktiviert wird. Wird AMPK nicht aktiviert, führt dies zu einer verminderten Glukoseaufnahme im Gewebe. Die reduzierte Energieversorgung der Zelle kann eine direkte Ursache für Müdigkeit sein. Oxalacetat erhöhte in Studien mit Diabetikern und Alzheimer-Patienten die Glukoseaufnahme [ 38 , 39 ] und bietet einen Mechanismus zur Erhöhung der für Zellfunktionen verfügbaren Brennstoffmenge.
ROS-Reduktion
Oxalacetat ist ein starkes Antioxidans, das sowohl Thiobarbitursäure als auch Wasserstoffperoxid im Gehirn reduziert [ 40 , 41 ]. Oxalacetat schützt außerdem die mitochondriale DNA vor Schäden durch Substanzen wie Kainsäure [ 42 ].
Diese sechs Stoffwechselveränderungen bei ME/CFS- und anderen Erschöpfungspatienten könnten die treibende Kraft der Erschöpfung sein. Die Normalisierung dieser Stoffwechselveränderungen durch Oxalacetat kann einen Zustand ohne Erschöpfung wiederherstellen.
Diese „Proof of Concept“-Studie unterlag mehreren Einschränkungen. Sie war nicht verblindet, da sie zunächst als Fallstudie mit der ME/CFS-Patientengruppe des Autors Dr. Kaufman begann. Positive Ergebnisse führten zu einer stärkeren Patientenbeteiligung und zur formellen Anerkennung als klinische Studie unter Aufsicht eines IRB. Da es keine Placebogruppe gab (nur ein historisches Placebo), erfolgte auch keine Randomisierung in eine separate Gruppe. Durch Facebook-Werbung wurden viele potenzielle Langzeitkandidaten für diese Studie identifiziert. Da diese Patienten jedoch nicht bezahlt wurden und keine dauerhafte Beziehung zu einem der Autoren dieser Studie hatten, waren die Abbruchraten in den Long-COVID-Gruppen höher als in den ME/CFS-Gruppen. Dies ist eine kleine Proof of Concept-Studie, und obwohl eine sehr hohe Signifikanz für die Verringerung von Müdigkeit festgestellt wurde, sollten die klinischen Untersuchungen fortgesetzt werden.
Abschluss
Diese kleine, nicht randomisierte, offene klinische „Proof-of-Concept“-Studie mit gesteigerter Dosis ergab beeindruckende, hochsignifikante Verbesserungen der Müdigkeit sowohl bei ME/CFS-Patienten als auch bei Long-COVID-Patienten. Die klinische Wirksamkeit wurde anhand der Abnahme des bimodalen Chalder-Fatigue-Scores von über 4 auf 4 oder weniger gemessen. Bis zu 33 % der Patienten mit ME/CFS und bis zu 46,8 % der Long-COVID-Müdigkeitspatienten erreichten nach 6 Wochen eine klinische Wirksamkeit gegen Müdigkeit mit einer oralen Behandlung mit wasserfreiem Enoloxalacetat. Dies ist gut vergleichbar mit einem historischen Placebo, das bei ME/CFS-Patienten eine klinische Verbesserung von 5,9 % erzielte. Sowohl die körperliche als auch die geistige Müdigkeit wurden bei ME/CFS- als auch bei Long-COVID-Müdigkeitspatienten signifikant verbessert. 1000–3000 mg wasserfreies Enoloxalacetat täglich waren für die Dauer der Studie in dieser Population sowohl sicher als auch verträglich. Diese Proof-of-Concept-Studie unterstützt die Weiterentwicklung von wasserfreiem Enoloxalacetat zur Behandlung von ME/CFS-Patienten und Long-COVID-Müdigkeitspatienten mit längeren randomisierten, placebokontrollierten Studien. Mögliche klinische Anwendungen mit wasserfreiem Enoloxalacetat, derzeit ein kommerzielles Nahrungsergänzungsmittel, könnten dazu beitragen, die Müdigkeit bei ME/CFS- und Long-COVID-Patienten zu reduzieren.
Verfügbarkeit von Daten und Materialien
Die während der vorliegenden Studie verwendeten und/oder analysierten Datensätze sind auf begründete Anfrage beim entsprechenden Autor erhältlich.
Änderungsverlauf
-
03. Oktober 2023
Anmerkung der Redaktion: Wir weisen darauf hin, dass Bedenken hinsichtlich der Methodik und Berichterstattung dieser klinischen Studie sowie einer unvollständigen Erklärung zu Interessenkonflikten geäußert wurden. Diese werden derzeit vom Chefredakteur geprüft. Sobald die Untersuchung der Bedenken abgeschlossen ist und alle Parteien Gelegenheit zur umfassenden Stellungnahme hatten, werden gegebenenfalls weitere redaktionelle Maßnahmen ergriffen.
Abkürzungen
- AEO:
-
Wasserfreies Enol-Oxalacetat
- AMPK:
-
AMP-aktivierte Proteinkinase
- GEBOT:
-
Zweimal täglich dosieren
- COVID:
-
Krankheit, die durch ein Coronavirus namens SARS-CoV-2 verursacht wird
- ME/CFS:
-
Myalgische Enzephalomyelitis/Chronisches Erschöpfungssyndrom
- NF-kB:
-
Nuklearfaktor Kappa B
- NAD+ und NADH:
-
Nicotinamidadenindinukleotid
- PGC-1alpha:
-
Peroxisom-Proliferator-aktivierter Rezeptor-Gamma-Koaktivator -1 alpha
- ROS:
-
Reaktive Sauerstoffspezies
- TID:
-
Dreimal täglich dosieren
Verweise
-
Evans WJ, Lambert CP. Physiologische Grundlagen der Müdigkeit. Am J Phys Med Rehabil. 2007;86(1 Suppl):S29-46.
-
Lock AM, Bonetti DL, Campbell ADK. Die psychologischen und physiologischen Auswirkungen von Müdigkeit auf die Gesundheit. Occup Med (London). 2018;68(8):502–11.
-
Barnett R. Müdigkeit. Lancet. 2005;366(9479):21.
-
Wan JJ, Qin Z, Wang PY, et al. Muskelermüdung: Allgemeines Verständnis und Behandlung. Exp Mol Med. 2017;49(10): e384.
-
Pennisi M, Malaguarnera G, Di Bartolo G, et al. Abnahme des Vitamin-D-Spiegels im Serum älterer Patienten mit Müdigkeit. Nährstoffe. 2019;11(10):2531.
-
Naviaux RK, Naviaux JC, Li K, et al. Stoffwechselmerkmale des chronischen Erschöpfungssyndroms. Proc Natl Acad Sci USA. 2016;113(37):E5472-5480.
-
Paul BD, Lemle MD, Komaroff AL, et al. Redox-Ungleichgewicht verbindet COVID-19 und Myalgische Enzephalomyelitis/Chronisches Erschöpfungssyndrom. Proc Natl Acad Sci USA. 2021;118(34):e2024358118.
-
Komaroff AL, Bateman L. Führt COVID-19 zu myalgischer Enzephalomyelitis/chronischem Erschöpfungssyndrom? Front Med (Lausanne). 2020;7: 606824.
-
Warburg O. Über den Ursprung von Krebszellen. Science. 1956;123(3191):309–14.
-
Kornberg MD. Der immunologische Warburg-Effekt: Evidenz und therapeutische Möglichkeiten bei Autoimmunität. Wiley Interdiscip Rev Syst Biol Med. 2020;12(5): e1486.
-
Icard P, Lincet H, Wu Z, et al. Die Schlüsselrolle des Warburg-Effekts bei der SARS-CoV-2-Replikation und der damit verbundenen Entzündungsreaktion. Biochimie. 2020;180:169–77.
-
Lawson N, Hsieh CH, March D, et al. Erhöhte Energieproduktion bei Patienten mit chronischem Erschöpfungssyndrom. J Nat Sci. 2016;2(10):e221.
-
Graham T, Sjogaard G, Lollgen H, et al. NAD in der Muskulatur des Menschen in Ruhe und während des Trainings. Pflugers Arch. 1978;376(1):35–9.
-
Sahlin K, Katz A, Henriksson J. Redoxzustand und Laktatansammlung im menschlichen Skelettmuskel während dynamischer Belastung. Biochem J. 1987;245(2):551–6.
-
Sweetman E, Kleffmann T, Edgar C, et al. Eine SWATH-MS-Analyse der Proteome peripherer mononukleärer Blutzellen bei Myalgischer Enzephalomyelitis/Chronischem Erschöpfungssyndrom zeigt eine mitochondriale Dysfunktion. J Transl Med. 2020;18(1):365.
-
Afrin LB, Weinstock LB, Molderings GJ. Die Hyperinflammation und die post-Covid-19-Erkrankung könnten auf einem Mastzell-Aktivierungssyndrom beruhen. Int J Infect Dis. 2020;100:327–32.
-
Gupta SC, Kim JH, Kannappan R, et al. Rolle der durch den nukleären Faktor kappaB vermittelten Entzündungswege bei krebsbedingten Symptomen und ihre Regulierung durch Nährstoffe. Exp Biol Med (Maywood). 2011;236(6):658–71.
-
Bower JE, Ganz PA, Irwin MR, et al. Müdigkeit und Genexpression in menschlichen Leukozyten: erhöhtes NF-kappaB und verringerte Glukokortikoid-Signalisierung bei Brustkrebsüberlebenden mit anhaltender Müdigkeit. Brain Behav Immun. 2011;25(1):147–50.
-
Morris G, Maes M. Erhöhter nukleärer Faktor-kappaB und Verlust von p53 sind Schlüsselmechanismen bei Myalgischer Enzephalomyelitis/Chronischem Erschöpfungssyndrom (ME/CFS). Med Hypotheses. 2012;79(5):607–13.
-
Filler K, Lyon D, Bennett J, et al. Zusammenhang zwischen mitochondrialer Dysfunktion und Müdigkeit: eine Literaturübersicht. BBA Clin. 2014;1:12–23.
-
Brown AE, Jones DE, Walker M, et al. Anomalien der AMPK-Aktivierung und Glukoseaufnahme in kultivierten Skelettmuskelzellen von Personen mit chronischem Erschöpfungssyndrom. PLoS ONE. 2015;10(4): e0122982.
-
Fisicaro F, Di Napoli M, Liberto A, et al. Neurologische Folgen bei Patienten mit COVID-19: eine histopathologische Perspektive. Int J Environ Res Public Health. 2021;18(4):1415.
-
Nogueira L. Akute Oxalacetat-Exposition erhöht die Widerstandsfähigkeit gegen Müdigkeit in in vitro Soleusmuskel der Maus. FASEB J. 2011. https://doi.org/10.1096/fasebj.25.1_supplement.1104.5 .
-
Germain A, Ruppert D, Levine SM, et al. Die metabolische Profilierung einer Kohorte zur Entdeckung von myalgischer Enzephalomyelitis/chronischem Erschöpfungssyndrom zeigt Störungen im Fettsäure- und Lipidstoffwechsel. Mol Biosyst. 2017;13(2):371–9.
-
Fukuda K, Straus SE, Hickie I, et al. Das chronische Erschöpfungssyndrom: ein umfassender Ansatz zu seiner Definition und Untersuchung. Internationale Studiengruppe zum chronischen Erschöpfungssyndrom. Ann Intern Med. 1994;121(12):953–9.
-
Chalder T, Berelowitz G, Pawlikowska T, et al. Entwicklung einer Müdigkeitsskala. J Psychosom Res. 1993;37(2):147–53.
-
Krupp LB, LaRocca NG, Muir-Nash J, et al. Die Fatigue-Schweregradskala. Anwendung bei Patienten mit Multipler Sklerose und systemischem Lupus erythematodes. Arch Neurol. 1989;46(10):1121–3.
-
Yang M, Keller S, Lin JS. Psychometrische Eigenschaften des PROMIS((R)) Fatigue Short Form 7a bei Erwachsenen mit myalgischer Enzephalomyelitis/chronischem Erschöpfungssyndrom. Qual Life Res. 2019;28(12):3375–84.
-
Cho HJ, Hotopf M, Wessely S. Die Placebo-Reaktion bei der Behandlung des chronischen Erschöpfungssyndroms: eine systematische Überprüfung und Metaanalyse. Psychosom Med. 2005;67(2):301–13.
-
Ijare O, Conway D, Cash A, et al. CBMT-49. Oxalacetat verändert den Glukosestoffwechsel in einer 13C-Isotopomerstudie bei Glioblastomen. Neuro-Onkologie. 2019;21(Supplement_6):vi43–4.
-
Morris G, Maes M. Oxidativer und nitrosativer Stress und immun-entzündliche Wege bei Patienten mit Myalgischer Enzephalomyelitis (ME)/Chronischem Erschöpfungssyndrom (CFS). Curr Neuropharmacol. 2014;12(2):168–85.
-
Wilkins HM, Harris JL, Carl SM, et al. Oxalacetat aktiviert die mitochondriale Biogenese im Gehirn, verbessert den Insulinweg, reduziert Entzündungen und stimuliert die Neurogenese. Hum Mol Genet. 2014;23(24):6528–41.
-
Williams DS, Cash A, Hamadani L, et al. Oxalacetat-Supplementierung erhöht die Lebensdauer von Caenorhabditis elegans über einen AMPK/FOXO-abhängigen Signalweg. Aging Cell. 2009;8(6):765–8.
-
Haslam JM, Krebs HA. Die Durchlässigkeit von Mitochondrien für Oxalacetat und Malat. Biochem J. 1968;107(5):659–67.
-
Booth NE, Myhill S, McLaren-Howard J. Mitochondriale Dysfunktion und die Pathophysiologie der Myalgischen Enzephalomyelitis/des Chronischen Erschöpfungssyndroms (ME/CFS). Int J Clin Exp Med. 2012;5(3):208–20.
-
Wilkins HM, Koppel S, Carl SM, et al. Oxalacetat verbessert die bioenergetischen Flüsse und die Infrastruktur neuronaler Zellen. J Neurochem. 2016. https://doi.org/10.1111/jnc.13545 .
-
Brown AE, Dibnah B, Fisher E, et al. Pharmakologische Aktivierung von AMPK und Glukoseaufnahme in kultivierten menschlichen Skelettmuskelzellen von Patienten mit ME/CFS. 2018. Biosci Rep. https://doi.org/10.1042/BSR20180242 .
-
Yoshikawa K. Studien zur antidiabetischen Wirkung von Natriumoxalacetat. Tohoku J Exp Med. 1968;96(2):127–41.
-
Vidoni ED, Choi IY, Lee P, et al. Sicherheits- und Zielbindungsprofil von zwei Oxalacetat-Dosen bei Alzheimer-Patienten. Alzheimer-Demenz. https://doi.org/10.1002/alz.12156 .
-
Desagher S, Glowinski J, Premont J. Pyruvat schützt Neuronen vor durch Wasserstoffperoxid verursachter Toxizität. J Neurosci. 1997;17(23):9060–7.
-
Puntel RL, Nogueira CW, Rocha JB. Krebs-Zyklus-Zwischenprodukte modulieren die Produktion von Thiobarbitursäure-reaktiven Spezies (TBARS) im Rattenhirn in vitro. Neurochem Res. 2005;30(2):225–35.
-
Yamamoto HA, Mohanan PV. Wirkung von Alpha-Ketoglutarat und Oxalacetat auf durch Kainsäure induzierte DNA-Schäden im Gehirn der Mitochondrien und Krampfanfälle bei Mäusen. Toxicol Lett. 2003;143(2):115–22.
Danksagung
Die Autoren danken dem Center for Complex Disease für seinen Zugang zu ME/CFS-Patienten.
Finanzierung
Diese Studie wird von Terra Biological LLC finanziert.
Autoreninformation
Autoren und Zugehörigkeiten
-
Terra Biological LLC, 3830 Valley Centre Drive, Ste 705 PMB 561, San Diego, CA, USA
Alan Cash
-
Zentrum für komplexe Krankheiten, Seattle, WA, USA
David Lyons Kaufman
Beiträge
DC stellte die ME/CFS-Patienten aus seiner Praxis zur Verfügung und führte die Patientenbeurteilungen durch. AC analysierte und interpretierte die Patientendaten hinsichtlich der Antworten aus der Patientenbefragung. Die Autoren trugen gleichermaßen zur Durchführung dieser Studie bei. Alle Autoren lasen und genehmigten das endgültige Manuskript.
Korrespondierender Autor
Korrespondenz mit Alan Cash .
Ethikerklärungen
Ethik-Genehmigung und Einwilligung zur Teilnahme
Sowohl die Post-COVID-Fatigue-Studie als auch die ME/CFS-Studie wurden vom Institute of Regenerative and Cellular Medicine, einem Institutional Review Board, geprüft und genehmigt. IRCM-2020–263, IRCM-2020.
Einwilligung zur Veröffentlichung
Nicht zutreffend.
Interessenkonflikt
Autor David Kaufman hat keine Interessenkonflikte. Autor Alan Cash ist leitender Angestellter eines Pharmaunternehmens, das die Finanzierung dieser klinischen Studie übernommen hat. Die Finanzierung erfolgte durch Terra Biological LLC.
